微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯气溶于水达到平衡形成饱和溶液,若其他条件不变,只改变某一条件,下列叙述正确的是:
A.再通入少量氯气,c(H+)/ c(ClO-)减小
B.通入具有漂白性的SO2气体,溶液的漂白性增强
C.氯水中存在的分子、离子共5种
D.加入少量水,水的电离平衡向正反应方向移动
参考答案:D
本题解析:溶液是饱和溶液,所以A中比值不变,A不正确。氯气能氧化SO2生成硫酸和盐酸,漂白性降低,B不正确。C不正确,应该是3种分子、4种离子。所以正确的答案选D。
本题难度:简单
2、实验题 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③???????????????????????
?
?
(2) 设V(Cl2)/V(CH4)=x,若理论上欲取代反应获得最多的氯化氢则x≥????????(3) D装置的石棉中均匀混有KI粉末其作用是 ????????????????????。
(4) 在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式??????????????????????????。
(5) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 ???????????。
A.分液法?????? B.蒸馏法????? C.萃取分液法??????? D.结晶法
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为?????????(填编号)
A、CH4???????B、CH3Cl???? C、CH2Cl2 ?????????D、CHCl3
参考答案:(12分) (每空2分)(1)干燥甲烷和氯气?(2)4??(
本题解析:
试题分析:(1)浓硫酸具有吸水性,而生成的氯气中含有水,所以B装置除具有控制气流速度、均匀混合气体之外,还具有干燥作用。
(2)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,如果设V(Cl2)/V(CH4)=x,因此理论上欲获得最多的氯化氢,则x值应保证甲烷被完全取代,即x≥4。
(3)氯气具有氧化性,KI中-1价的碘能被氯气氧化,产物为氯化钾固体和碘单质,所以,D装置的石棉中均匀混有KI粉末的作用是吸收过量的氯气。
(4)甲烷与氯气反应生
本题难度:困难
3、选择题 为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是(??? )
A.NaClO溶液的漂白原理与Na2O2、SO2相同
B.1molCl2与足量NaOH溶液反应转移2mol电子
C.NaClO溶液的消毒原理是使蛋白质变性
D.实验室在处理氯气尾气时,可采用饱和的石灰水吸收
参考答案:C
本题解析:略
本题难度:简单
4、填空题 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
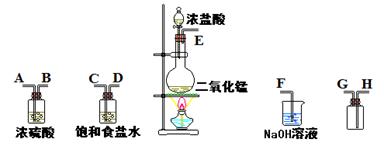
(1)连接上述仪器的正确顺序(填各接口处的字母):???接???;???接???;
???接???;???接???。
(2)装置中,饱和食盐水的作用是????????????;NaOH溶液的作用是?????????????。
(3)化学实验中常用湿润的淀粉—KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到????????????,反应方程式??????????????。
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:?????????????????
②NaOH溶液中发生的反应:??????????????????????
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①标出该反应电子转移的方向和数目
②氧化剂和还原剂的物质的量之比为???????;
③当有0.2mole-转移时被氧化的HCl的质量是????;该反应中被氧化和未被氧化的盐酸的物质的量之比是????????,
④如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将????????。
A.≥1.68L
B.>1.68L
C.≤1.68L
D.<1.68L
参考答案:(1)E接C;D接A;B接H;G接F。
(2)除去氯气
本题解析:
试题分析:二氧化锰和浓盐酸共热产生氯气,将气体依次通过饱和食盐水和浓硫酸,分别除去HCl和H2O,然后用向上排空气法收集氯气,最后用氢氧化钠溶液吸收尾气。可用湿润的淀粉-KI试纸检验氯气是否收集满,Cl2+2KI=I2+2KCl,现象为试纸变蓝。高锰酸钾与浓盐酸反应中,高锰酸钾是氧化剂,盐酸是还原剂,16molHCl反应被氧化的HCl被10mol,氧化剂、还原剂物质的量比为2:10。每1molHCl被氧化转移电子1mol,反应中被氧化和未被氧化的HCl物质的量比为10:6。随着反应进行,盐酸由浓变
本题难度:一般
5、实验题 (16分)某实验小组用浓盐酸和MnO2制取并探究Cl2化学性质,设计装置图如下图所示:

(1)A是氯气发生装置(省略未画),制备Cl2的化学反应离子方程式是???????????????????????,? A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有??????????????????。
(2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生的化学反应方程式为:
??????????????????????????????????????????。
(3)同学们在实验中发现,若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
①提出合理假设
假设1:H+的浓度不够大;
假设2:??????????????????????????????????????;
假设3:_________________________ _?????????????。
②设计实验方案,进行实验。在答题卷上写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓H2SO4、NaCl固体、MnO2固体、1mol/L稀盐酸、1mol/LAgNO3溶液、淀粉-KI溶液
实验步骤
| 预期现象与结论
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2,???????????????????
?????????????????????????????????。
| ?
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2,????????????????????
?????????????????????????????????。
| ?
参考答案:(1)MnO2+4H++2Cl- 本题解析:本题考查了氯气的制取原理:MnO2+4H++2Cl- 本题解析:本题考查了氯气的制取原理:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O
(1)制取氯气是固液加热的方式;一般用分液漏斗装液体,烧瓶做为反应容器。
(2)氯气在制取过程中只除去了HCl,并没有干燥,在加热条件下与C反应,产物为CO2和HCl,可知反应物为氯气、C和水
(3)探究氯气的制
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772