C.碳酸钠溶液中通入少量HCl:+ H+ =
D.氧化铁可溶于氢碘酸:Fe2O3+ 6H+ = 2Fe3+ + 3H2O
参考答案:
D
本题解析:略
本题难度:一般
2、选择题 下列反应对应的离子方程式中正确的是(??)????????????????????????????
A.少量氯气通入碘化亚铁溶液中:Cl2+2Fe2+- 2Cl-+ 2Fe2+
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
C.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH+2H++SO42-══BaSO4↓+2H2O
D.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+====Fe2++3H2O
参考答案:C
本题解析:碘离子的还原性强于亚铁离子的,所以当氯气不足时,首先氧化碘离子,A不正确。B中应该生成氢氧化镁沉淀,B不正确。铁离子具有氧化性,能氧化碘离子,生成单质碘和亚铁离子,D不正确,因此正确的答案选C。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.用Pt电极电解少量的MgC12溶液:2H2O+2Cl-通电H2↑+C12↑+2OH-
B.等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:
Ba2++2OH-+2NH4++SO42-=BaSO4↓+2 NH3·H2O
C.将Na2O2固体投入H218O:2H218O+2 Na2O2=4OH-+4Na++18O2↑
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:
4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
参考答案:D
本题解析:A中应该生成氢氧化镁沉淀,不正确。A中氢氧化钡是不足的,应该生成硫酸钡和氢氧化亚铁沉淀,不正确。过氧化钠和水反应中,过氧化钠既是氧化剂,又是还原剂,因此水中的氧原子进入氢氧化钠中,不正确。所以正确的答案选D。
本题难度:一般
4、填空题 (10分)写出下列反应的离子方程式
(1)过氧化钠与水?????????????????????????????????????????????? ???????????; ???????????;
(2)金属铝与稀硫酸溶液??????????????????????????????????????????????????;
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液???????????????????????????;
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A)??????????????????????????????????????????????????????????????????,
(B)????????????????????????????????????????????????????????????????。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
5、填空题 含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑,则生成物A的化学式______________
②某强酸性反应体系中,反应物和生成物共六种物质:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。
写出该反应的离子方程式:_______________________________________________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如图所示的A和B曲线,试回答下列问题:
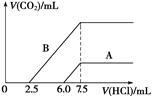
①_______曲线正确,天然碱的化学式为___________,
②加盐酸后产生CO2气体体积(标准状况)的最大值为?? _____________mL。
(3) 常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
参考答案:(1)①NaHCO3????②2MnO4-+5H2O2+6H
本题解析:
试题分析:(1)①化学反应的过程就是原子重新组合的过程。在这个过程中,元素的种类及原子个数不变。可得A化学式为:NaHCO3。该反应中H2O2只发生了如下过程:H2O2→ O2。H2O2失去电子,作还原剂,则还有氧化剂MnO4-,反应后该微粒转化为Mn2+.结合原子守恒和电子守恒。可得离子方程式是:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。(2) ①Na2CO3与盐酸反应分步进行。首先发生:Na2CO3+HCl="NaCl+" NaHCO3.当Na2CO3完全转化为NaHC
本题难度:困难
|