微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关叙述正确的是
A.某无色溶液中加入足量稀HCl,有气体产生,且该气体能使澄清石灰水变浑浊,则该溶液中一定含有CO32-
B.某溶液中加入BaCl2溶液有白色沉淀产生,再加入稀硝酸白色沉淀不溶解,则原溶液中一定含有SO42-
C.某溶液中加入NaOH溶液产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定含有NH4+
D.某气体通入到品红溶液中,品红溶液褪色,则该气体一定是SO2
2、选择题 某无色溶液能与铝作用生成H2,则溶液中可能大量共存的离子组是???
A.H+ Ba2+ Mg2+ Cl-
B.Cl- CO32- Cu2+ Fe2+
C.NO3- K+ H+ SO42-
D.OH- Na+ NO3-Cl-
3、选择题 在下列各溶液中,离子一定能大量共存的是 [???? ]
A.强碱性溶液中: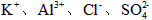
B.含有0.1 mol·L-1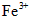 的溶液中:
的溶液中: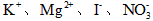
C.含有0.1 mol·L-1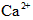 溶液在中:
溶液在中: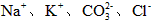
D.室温下,pH=1的溶液中: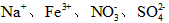
4、填空题 硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下。
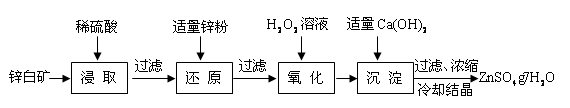
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
5、选择题 下列各组离子,在碱性条件下能大量共存,在强酸性条件下发生氧化还原反应的是
A.Mg2+、Na+、SO42-、HCO3—
B.Na+、K+、NO3—、SO32—
C.K+、Na+、SiO32—、ClO—
D.NH4+、Na+、SO42—、NO3—