微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
A.c(H+)> c(F-)
B.c(H+)> c(HF)
C.c(OH-)> c(HF)
D.c(HF) > c(F-)
参考答案:BC
本题解析:电离后,因水也电离产生H+,所以c(H+)>c(F-),A对;c(H+)=c(F-)约为0.01,c(HF)约0.09,B错;c(OH-)为10-12 c(OH-)﹤ c(HF),C错;c(HF) > c(F-),D对。
【考点定位】本题考查弱电解质的电离。
本题难度:困难
2、填空题 (12分:除注明分数的小题之外,其余为1分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是______________(2分),在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③___________④____________
B请写出通入⑥的化学方程式__________________________________
参考答案:(1)C (1分);(2)1~100 (1分)
本题解析:
试题分析:(1)因元素的化合价处于中间价态时,既能升高,又能降低,既有氧化性又有还原性,只有C中铁为+2价,符合条件;(2)透明的红褐色液体是胶体,胶体的粒子直径1nm<d<100nm;(3)Fe3+能与铜反应得到Fe2+和Cu2+,离子方程式为: 2Fe3++Cu===2Fe2++Cu2+;由于滴入KSCN溶液呈红色,证明溶液中Fe3+有剩余,溶液中含有的金属阳离子是:Fe3+、Fe2+、Cu2+;43.05g沉淀是AgCl,其物质的量为0.3mol,溶液中c(Cl-)=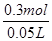 =6.0mol/L;(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;C、要证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有Fe2+;C错误;故选B;(5)A、制取的是FeCl3溶液,金属①是Fe;滤液②是FeCl2氯化亚铁溶液;加入的铁过量,滤渣③是Fe和Cu;制取FeCl3,溶解滤渣中的铁,应加入④是盐酸; B、⑥是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。
=6.0mol/L;(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;C、要证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有Fe2+;C错误;故选B;(5)A、制取的是FeCl3溶液,金属①是Fe;滤液②是FeCl2氯化亚铁溶液;加入的铁过量,滤渣③是Fe和Cu;制取FeCl3,溶解滤渣中的铁,应加入④是盐酸; B、⑥是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。
考点:考查铁及铁的化合物的性质、胶体的性质。
本题难度:一般
3、选择题 用相对分子质量为43的烷基取代甲苯苯环上的一个氢原子所得的芳香族产物数目为
A.3种
B.4种
C.5种
D.6种
参考答案:D
本题解析:相对分子质量为43的烷基为C3H7---有丙基也有异丙基,取代甲苯苯环上的一个氢原子所得的芳香族产物有邻对位,所以6种。
本题难度:困难
4、选择题 某饱和一元醇和饱和一元醛的混合物共3g,跟足量的银氨溶液完全反应后,可还原出16.2g银,下列说法正确的是
A.一定是甲醛
B.可能是乙醛
C.混合物中醇和醛的质量比为1∶3
D.混合物不可能由甲醇和甲醛组成
参考答案:A
本题解析:一个醛基可以还原出2mol银;16.2g银为0.15mol;根据R-CHO—2Ag,用极值法判断,假设醛为3g,知M=3g∕0.75mol=40g∕mol,而CH3CHO为44 g∕mol >40g∕mol,所以,M<40g∕mol只有甲醛。
本题难度:一般
5、选择题 氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH。下列叙述中错误的是 ( )。
A.“某物质”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
参考答案:D
本题解析:A项,用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH,Cu元素由+2价变为+1价,则CuSO4作氧化剂,“某物质”为还原剂,表现出还原性;B项,CuH与盐酸发生氧化还原反应:2CuH+4HCl=2CuCl2+3H2↑;C项,HNO3具有强氧化性,与CuH反应时,+1价Cu、-1价H均被氧化成最高价态;D项,Cl2具有强氧化性,CuH具有强还原性,二者反应会生成CuCl2和HCl。
本题难度:一般