微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有K2SO4和Fe2(SO4)3的混合溶液,含Fe3+的物质的量浓度为0.1 mol/L,而SO42-的物质的量浓度为
0.3 mol/l,则混合液中K+的物质的量浓度为 [???? ]
A.0. 15 mol/L
B.0.3 mol/L
C.0. 45 mol/L
D.0.6 mol/L
参考答案:B
本题解析:
本题难度:简单
2、选择题 一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是( )
A.该温度和压强可能是标准状况
B.标准状况下该纯净物若为气态,其体积约是22.4 L
C.该气体中每个分子含有2个原子
D.若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L
参考答案:A
本题解析:由分子数和原子数的关系可知该分子为双原子分子,且其物质的量为1 mol。若该物质为气态,则其在标准状况下的体积为22.4 L,故该温度和压强不可能是标准状况,在此状况下,Vm=30 L·mol-1。
本题难度:一般
3、选择题 对1 mol·L-1的Na2SO4溶液的叙述中正确的是(??? )
A.溶液中含有1 mol Na2SO4
B.1 L溶液中含有142 g Na2SO4
C.1 mol Na2SO4溶于1 L水
D.将322 g Na2SO4·10H2O溶于少量水后再将其稀释成1 000 mL
参考答案:BD
本题解析:当1 L溶液中含有1 mol Na2SO4时,它的物质的量浓度为1 mol·L-1,故选项B正确;又知Na2SO4·10H2O的物质的量为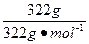 ="1" mol,其中含Na2SO4的物质的量为1 mol,故浓度为1 mol·L-1,选项D正确;A项未说明溶液的体积;C项是1 L水不是1 L溶液,故A、C不正确。
="1" mol,其中含Na2SO4的物质的量为1 mol,故浓度为1 mol·L-1,选项D正确;A项未说明溶液的体积;C项是1 L水不是1 L溶液,故A、C不正确。
本题难度:简单
4、填空题 (10分)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有______________(选填序号),还缺少的仪器有________(写仪器名称)。
(2)配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体________mL(保留一位小数),量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是_________。
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线
参考答案:(1)②④⑥ 100 mL容量瓶、玻璃
本题解析:
试题分析:(1)用液体配制溶液时用到的仪器有量筒、烧杯、容量瓶、玻璃棒、胶头滴管等,不要用到的是②④⑥。配制一定物质的量浓度的溶液一定要用到容量瓶,所以还缺100 mL容量瓶、玻璃棒。(2) 溶液稀释公式C浓V浓=C稀V稀有:18.4mol/L ×V浓="1mol/L" ×100 mL ,得C浓=5.4 mL。量筒选用10 mL。(3) A.容量瓶中原来含有少量蒸馏水对溶液浓度没有影响,B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容 ,会造成浓度偏大,因为浓硫酸稀释的时候放热,所以温度较高,在较高温度下进行定容,待冷却后体积就会变小,造成浓度偏高。C.烧杯没有洗涤会损失部分硫酸,造成浓度偏小。D.向容量瓶中加水定容时眼睛一直仰视刻度线,配出的溶液体积偏大,浓度偏低。
考点:一定物质的量浓度溶液的配制。
本题难度:一般
5、计算题 (4分)硝酸铜受热易分解:2Cu(NO3)2 ?2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
?2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2
2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2 N2O4,2NO2=2NO+O2等反应)。
N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
⑴若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是__________g。
⑵若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况)是_____________L。
⑶若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能
是_________g。
参考答案:(1)2.4g(1分);⑵O2,0.168L(各1分,共2分
本题解析:(1)5.64gCu(NO3)2的物质的量是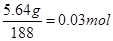 ,所以可以生成0.03mol氧化铜,质量是0.03mol×80g/mol=2.4g。
,所以可以生成0.03mol氧化铜,质量是0.03mol×80g/mol=2.4g。
(2)如果生成氧化亚铜,则方程式为4Cu(NO3)2 本题难度:一般
本题难度:一般