微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)用______(填仪器名称)量取10.00mL食用白醋,在______(填仪器名称)中用水稀释后转移到100mL______(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴______作指示剂.
(3)读取盛装0.1000mol/L?NaOH?溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为______mL.
(4)滴定.当______时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
滴定次数
实验数据(mL) | 1 | 2 | 3 | 4
V(样品)
20.00
20.00
20.00
20.00
V(NaOH)(消耗)
15.95
15.00
15.05
14.95
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积?V=15.95+15.00+15.05+14.95
4
mL=15.24mL.
指出他的计算的不合理之处:______.
按正确数据处理,可得c(市售白醋)=______mol/L;市售白醋总酸量=______g/100mL.
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的______(填写序号).
a.pH??? b.电离度??? c.电离常数??? d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.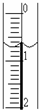
参考答案:I.(1)用滴定管(或10mL移液管)(量取10.00mL食
本题解析:
本题难度:一般
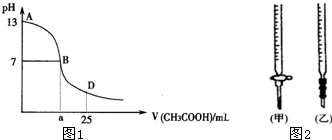
2、填空题 I.图1为向25mL?0.1mol-L-1?NaOH溶液中逐滴滴加0.2mol-L-1?CH3COOH溶液过程中溶液pH的变化曲线.
请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?______区间(若正确,此问不答).
(2)关于该滴定实验,从下列选项中选出最恰当的一项______.(选填字母) | ? | 锥形瓶中溶液 | 滴定管
中溶液 | 选用
指示剂 | 选用
滴定管
A
碱
酸
石蕊
(乙)
B
酸
碱
甲基橙
(甲)
C
碱
酸
酚酞
(甲)
D
酸
碱
酚酞
(乙)
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是______.
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+).(填“>”、“<”或“=”)
Ⅱ.t℃时,某稀硫酸溶液中c(H+)=10-a?mol-L-1,c(OH-)=10-b?mol-L-1,已知a+b=13:
(5)该温度下水的离子积常数Kw的数值为______.
(6)该温度下(t℃),将100mL?0.1mol-L-1的稀H2SO4溶液与100mL?0.4mol-L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=______.
参考答案:(1)NaOH与CH3COOH恰好完全反应:NaOH+CH3
本题解析:
本题难度:一般
3、实验题 用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。试回答:
(1)在25℃时,1L水中约能溶解0.01g碳酸钡,则该温度下碳酸钡的溶度积 Ksp=________。
(2)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用__________指示剂,理由是______________________;判断到达滴定终点的实验现象是________________________。
(3)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:
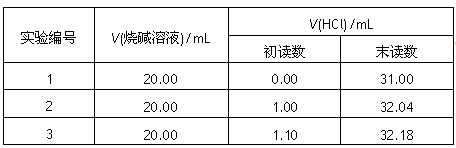
①实验3到达滴定终点时所耗HCl溶液的体积为__________________;依据表中数据,计算出烧碱样品中含NaOH的质量分数为__________%。(小数点后保留两位数字)
②滴定时的正确操作是________________________________。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是____________。
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
参考答案:(1)2.58×10-9(2.5×10-9~2.6×10-9
本题解析:
本题难度:一般
4、实验题 中和滴定实验
⑴ 取体积相同(25mL)的两份溶液,将其中一份放在空气中一段时间后,溶液的pH __________(填“增大”“减小”或“不变”)其原因是__________ 。用已知浓度的盐酸中和上述两份溶液。若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为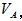 中和另一份溶液消耗盐酸的体积为 中和另一份溶液消耗盐酸的体积为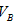 ,则 ,则
①以甲基橙为指示剂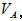 和 和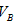 的关系是__________ 。 的关系是__________ 。
②以酚酞为指示剂时,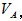 和 和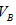 的关系是__________ 。 的关系是__________ 。
⑵ 某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作(? ?? )
A. 在250mL的容量瓶中定容配成250mL烧碱溶液
B. 用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C. 在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D. 将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写) _________→ _________→________ → D →_______ 。
(2)滴定管的读数应注意_____________ 。
(3)E中在锥形瓶下垫一张白纸的作用是__________ 。
(4)D步骤中液面应调节到________ ,尖嘴部分应__________ 。
(5)滴定终点时锥形瓶内溶液的pH约为 ____________,终点时颜色变化是__________ 。
(6)若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?_____________(指偏高、低或不变)
(7)该烧碱样品纯度的计算式为_______________ 。
参考答案:⑴① 减小;NaOH溶液吸收空气中CO2,使溶液中因部分Na
本题解析:
本题难度:一般
5、选择题 当用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸时,下列操作使测定结果(酸的浓度)偏低的是( )
A.碱式滴定管滴至终点,俯视读数
B.碱液移入锥形瓶后,加入10mL蒸馏水
C.碱式滴定管注入碱溶液后,尖嘴有气泡时便开始滴定,滴定后气泡消失
D.碱式滴定管用蒸馏水润洗后,未用标准液润洗
参考答案:A
本题解析:
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772