微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)某强酸性溶液X含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO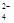 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
参考答案:(1)Fe2+、SO42-、NH4+、Al3+;
(2
本题解析:
试题分析:由题干知该溶液为强酸性溶液所以CO32-、SO32-一定不存在;由流程图中信息可知:加过量Ba(NO3)2生成气体A为NO,气体D为NO2,溶液E为HNO3溶液,可判定原溶液一定有Fe2+,一定无NO3-;由此可推断沉淀G为Fe(OH)3;加过量Ba(NO3)2生成沉淀C为BaSO4,则原溶液中一定有SO42-无Ba2+;
加过量NaOH溶液生成气体F为NH3,则溶液中一定有NH4+;通入过量CO2时生成沉淀I为Al(OH)3,则原溶液中一定有Al3+,若NO、NH3、Al(OH)3均为0.01 mol、BaSO4为0.07 mol,综合上述分析可知10 mL X溶液中Fe2+、NH4+、Al3+、SO42-的物质的量各为0.03mol、0.01mol、0.01mol、0.07 mol;又知10 mL X溶液中n(H+)=0.04 mol,恰好符合电荷守恒因此如果可以测定原溶液中还有Fe3+则有Cl-,否则没有Cl-.
考点:了解离子反应的概念、离子反应发生的条件。了解常见离子的检验方法。
点评:熟练掌握离子的性质进行离子检验,同时也要注意离子间的量的关系如第(3)题中应用电解质溶液中的电荷守恒关系。
本题难度:困难
2、选择题 下列各组离子在指定溶液中一定能大量共存的是
A.发生析氢腐蚀的溶液中:NH4+、Ba2+、AlO2-、Cl-
B.c(H+)/ c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
C.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
D.甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl-
参考答案:B
本题解析:
试题分析:A.发生析氢腐蚀的溶液中呈酸性,含有H+,与AlO2-不能大量共存,错误;B.c(H+)/ c(OH-)=1012的溶液中显酸性,NH4+、Al3+、NO3-、Cl- 能大量共存,正确;C.由水电离的c(H+)=1×10-14mol·L-1的溶液中,水的电离被抑制,溶液呈酸性或碱性, HCO3-不能大量共存,错误;D.甲基橙呈红色的溶液中,溶液呈酸性,CO32-不能大量共存,错误。
本题难度:一般
3、选择题 下列叙述中正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.碳酸钠溶液呈碱性,医疗上常用碳酸钠治疗胃酸过多
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除
参考答案:D
本题解析:
试题分析:A、二氧化氯具有氧化性,用于自来水的杀菌消毒,错误;B、碳酸钠溶液的碱性比碳酸氢钠溶液的碱性强,所以医疗上常用碳酸氢钠治疗胃酸过多,错误;C、加入盐酸,温度不变,所以水的离子积不变,错误;D、碳酸钙的溶解度比硫酸钙的溶解度小,所以锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,硫酸钙转化为碳酸钙,然后碳酸钙与稀盐酸反应生成易溶的氯化钙除去,正确,答案选D。
本题难度:一般
4、选择题 室温下,下列各组离子在指定溶液中能大量共存的是
?????????????
A.含有大量NO—2的水溶液中:Na+、Fe2+、SO2-4、H+
B.在pH=12的溶液中:ClO—、S2-、Na+、K+
C.能使pH试纸变蓝的溶液 NH4+Na+SO42-Fe3+
D.含有大量HCO—3的澄清透明溶液中:K+、C6H5O—、Cl—、CH3COO—
参考答案:D
本题解析:A错,NO—2、Fe2+、H+、不能共存;B错,在碱性溶液中ClO—、S2-、不能共存;C错,能使pH试纸变蓝的溶液为碱性溶液,NH4+?、Fe3+不能共存;D正确;
本题难度:一般
5、选择题 下列各组离子能大量共存,且溶液为无色透明的是
A.Al3+、AlO2-、NO3-、Cl-
B.CrO42-、H+、K+、NO3-
C.Ba2+、Na+、HCO3-、OH-
D.K+、SO42-、S2-、Na+
参考答案:D
本题解析:
试题分析:A中Al3+与AlO2-发生双水解而不共存,故A错误;B中CrO42-有颜色,故B错误;CHCO3-与OH-反应,故C错误;D可以大量共存,故D正确。
考点:离子能否大量共存。
本题难度:一般