微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验可行的是??????????????????(? )
A.可用激光笔区别淀粉溶液和食盐溶液
B.加入盐酸以除去硫酸钠中的少许碳酸钠杂质
C.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D.除去BaSO4固体中混有的BaCO3:加过量硫酸后,过滤、洗涤
参考答案:A
本题解析:淀粉溶液是胶体,有丁达尔现象;B项会引入新的杂质NaCl;配制FeCl3胶体无需用NaOH溶液,否则会生成Fe(OH)3沉淀;D项中不能是硫酸,生成硫酸钡阻止反应继续进行。
本题难度:一般
2、选择题 下列各组混合物中,可以用分液漏斗分离的是( )
A.乙酸和乙醇
B.乙酸乙酯和水
C.酒精和水
D.四氯化碳和苯
参考答案:A、乙酸和乙醇互溶,不能用分液漏斗进行分离,故A错误;
本题解析:
本题难度:简单
3、选择题 为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是(???)
选项
| 被提纯的物质(杂质)
| 除杂试剂
| 分离方法
|
A
| 乙酸乙酯(乙酸)
| 饱和碳酸钠溶液
| 分液
|
B
| NH3(H2 O) O)
| 浓硫酸
| 洗气
|
C
| KCl固体(I2)
| KO H溶液 H溶液
| 加热
|
D
| 苯(苯酚)
| 浓溴水
| 过滤
参考答案:A
本题解析:略
本题难度:简单
4、填空题 (8分)选择适当的试剂除去下列各组括号中的杂质,写出除杂反应的化学方程式,并注明反应类型:
⑴乙烷(乙烯):除杂试剂:????????,反应方程式:???????????????????????????,
反应类型:??????????????。
⑵乙酸乙酯(乙酸):除杂试剂:????????,反应方程式:???????????????????????????,
反应类型:??????????????。
参考答案:⑴溴水(1分),Br2+CH2=CH2→CH2BrCH2Br
本题解析:(1)由于酸性高锰酸钾溶液能把乙烯氧化生成CO2气体,所以除去乙烷中的乙烯要利用溴水和乙烯的加成。
(2)由于饱和碳酸钠溶液能够吸收乙酸,降低乙酸乙酯的溶解度,所以除去乙酸乙酯中的乙酸,可以利用饱和碳酸钠溶液。
本题难度:一般
5、填空题 实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程如下:


(1)根据图甲所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为________。图乙表示镍的浸出率与温度的关系,当浸出温度高于70 ℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是
________________________________________________________________。
(2)工艺流程中副产品的化学式为______________。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Fe(OH)3
| Fe(OH)2
| Ni(OH)2
| 开始沉淀的pH
| 1.5
| 6.5
| 7.7
| 沉淀完全的pH
| 3.7
| 9.7
| 9.2
?
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:_____________________________________________
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3molL-1,则Ca2+的浓度为________mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为_______________________________________。
参考答案:BaSO4 温度升高,Ni2+的水解程度增大
(2)C
本题解析:(1)BaO与H2SO4反应得到BaSO4沉淀,进入浸出渣;Ni2+会发生水解反应:Ni2++2H2O Ni(OH)2+2H+,该反应为吸热反应,故温度升高,平衡右移,Ni(OH)2含量增大,镍的浸出率降低。(2)CuS、S灼烧后转化为CuO和SO2,CuO被硫酸酸浸转化为硫酸铜溶液,结晶析出CuSO4·5H2O。(3)按题目操作无法将Fe2+除尽,从而导致有杂质存在,故可将Fe2+氧化为Fe3+后,再调pH,以便除去全部的铁元素。(4)c(Ca2+)= Ni(OH)2+2H+,该反应为吸热反应,故温度升高,平衡右移,Ni(OH)2含量增大,镍的浸出率降低。(2)CuS、S灼烧后转化为CuO和SO2,CuO被硫酸酸浸转化为硫酸铜溶液,结晶析出CuSO4·5H2O。(3)按题目操作无法将Fe2+除尽,从而导致有杂质存在,故可将Fe2+氧化为Fe3+后,再调pH,以便除去全部的铁元素。(4)c(Ca2+)= = =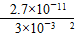 =3×10-6(mol·L-1)。(5)先根据题意写出ClO-+Ni2+―→2NiOOH·H2O+Cl-,然后再根据电荷守恒和原子守恒配平。 =3×10-6(mol·L-1)。(5)先根据题意写出ClO-+Ni2+―→2NiOOH·H2O+Cl-,然后再根据电荷守恒和原子守恒配平。
本题难度:困难
|
|