微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊。若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断该气体和广口瓶中盛放的物质分别是( )
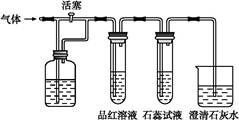
A.CO2和浓H2SO4
B.SO2和NaHCO3溶液
C.Cl2和NaHCO3溶液
D.Cl2和饱和氯化钠溶液
参考答案:B
本题解析:打开和关闭活塞后品红溶液、石蕊试液、澄清石灰水的变化如表所示:
选项
关闭活塞
打开活塞
品红
溶液
石蕊
试液
澄清
石灰水
品红
溶液
石蕊
试液
澄清
石灰水
A
无变化
变红
浑浊
无变化
变红
浑浊
B
无变化
变红
浑浊
褪色
变红
浑浊
C
无变化
变红
浑浊
褪色
先变红
后褪
本题难度:一般
2、简答题 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:
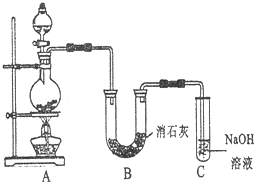
(1)A为实验室制氯气的发生装置,某学生用12mo1?L-1的浓盐酸100mL和足量的MnO2反应制Cl2.
(2)写出制漂白粉化学方程式是______.
(3)此实验所得漂白粉的有效成分偏低.该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______.
②避免另一个副反应的发生,可将装置作何改进______.
参考答案:(2)因氯气与消石灰反应生成氯化钙、次氯酸钙和水,
化
本题解析:
本题难度:一般
3、填空题 水是生命之源。饮用水消毒作为控制水质的一个重要环节,液氯消毒是最早的饮用水消毒方法。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)氯气溶于水能杀菌消毒的原因是?????????????????????????????????????????。
(2)在ClO2的制备方法中,有下列两种制备方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是???????????????????????????????????。
(3)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO2-也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
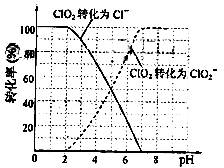
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式???????????????????????????????????????????。
②配制Na2S2O3标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的????(填字母代号)。
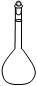 ??????
?????? ????????
???????? ????????
???????? ???????
???????
a??????????? b??????????? c???????? d???????? e
③请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:调节溶液的pH≤2.0。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
④滴定终点的现象是??????????????????????????????????????????????????。
⑤根据上述分析数据,测得该引用水样中的ClO2-的浓度为?????mg·L-1(用含字母的代数式表示)。
(4)判断下列操作对ClO2-的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,使测定结果??????????????????。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果????????。
参考答案:(1)生成的HClO具有强氧化性,可以杀菌(2分)
(
本题解析:
试题分析:(1)氯气的自来水消毒属于氢氧化性消毒,因此原理是氯气与水反应生成的HClO有强氧化性,起到杀菌消毒作用。
(2)根据题干中的介绍,氯气用于自来水消毒容易生成对人体有害的有机氯代物,所以方法二中产生的ClO2气体中不含氯气,因此制得的二氧化氯更加的安全。
(3) ①从本题题干和图像中得知,溶液pH≤2.0时,ClO2-被I- 还原为Cl- ,因此反应的离子方程式为ClO2-+4H++4I-=Cl-+2I2+2H2O,要注意酸性环境。
②一定浓度溶液的配制需要使用的仪器主
本题难度:困难
4、计算题 实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:?
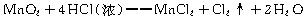
若产生的氯气的物质的量为0.5 mol。试计算:?
(1)参加反应的MnO2的质量。?
(2)参加反应的HCl的物质的量。?
(3)反应中被氧化的HCl的物质的量。
参考答案:(1)43.5 g (2)2 mol (3)1 mol
本题解析:根据反应的方程式可得?
MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O???被氧化的HCl的物质的量
87 g?? 4 mol????????????? 1 mol???????? 2 mol
(43.5 g)? (2 mol)?????????? 0.5 mol?????? (1 mol)
本题难度:简单
5、填空题 新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空。
(1)使新制氯水呈现浅绿色的物质是 ;?????????????????
(2)能起杀菌消毒作用,光照易分解的弱酸是 ;?????????????????????????
(3)能与硝酸银溶液作用生成白色沉淀的离子是 。??????????????????????????
参考答案:⑴Cl2 ⑵HClO ⑶Cl-
本题解析:本题通过新制氯水中含有的粒子所表现出的不同性质,考查学生分析一些简单的实验现象和实际问题的能力。氯水是氯气溶于水得到的混合物,其中有H2O、Cl2、HClO等分子和H+、Cl-、ClO-、OH-等离子,在不同的反应中,起作用的粒子不完全相同。本题能力层次为C,属容易题。
本题难度:简单