微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是(???)
A.在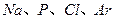 四种元素中,最高正化合价数值最大的是P
四种元素中,最高正化合价数值最大的是P
B.在N、F、Mg、Cl四种元素中,原子半径最小的是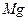
C.原子序数从3—10的元素,随着核电荷数的递增,原子的最外层电子数递增
D.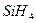 (硅烷)比
(硅烷)比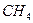 稳定
稳定
参考答案:C
本题解析:
本题难度:简单
2、推断题 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
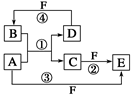
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为___________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是__________________________,
已知光照条件下D与F反应生成B,写出该反应的化学方程式:___________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________。
参考答案:(1) 本题解析:
本题解析:
本题难度:一般
3、填空题 (10分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大,已知A、C位于同一主族,A元素在元素周期表中原子半径最小,B、D原子最外层电子数相等,且B、D原子序数之和是A、C原子序数之和的两倍。
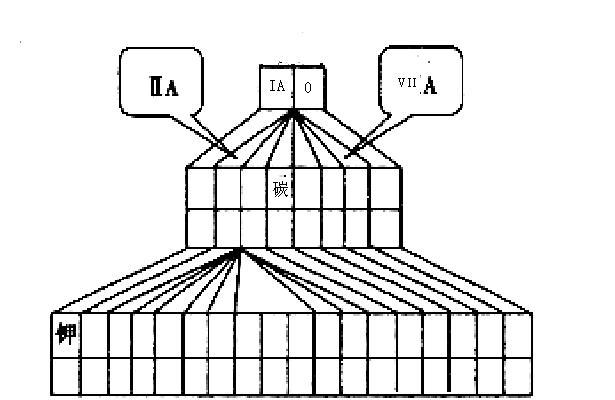
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出A、B、C、D四种元素的元素符号。
(2)图中将过渡元素涂黑。
(3)由上述四种元素中的某几种所形成的具有漂白作用物质的化学式(写出两种):_______、______。
参考答案:如图所示
 本题解析:
本题解析:
本题难度:简单
4、选择题 根据以下叙述和元素周期表的有关知识,回答6—7题:主族元素的性质主要由其原子的最外层电子数和电子层数决定,若元素的最外层电子数为m,电子层数为n,一般具有这样的规律:m>n的元素为非金属元素;m≤n的元素为金属元素。
6.下列有关结论正确的是(??? )
A.主族元素的性质随着原子量的递增而呈周期性变化
B.元素的金属性与非金属性递变规律最显著的是第三周期元素和第ⅣA族元素
C.ⅠA族和ⅦA族元素的单质一般都没有同素异形体
D.原子最外层电子数等于电子层数的元素均为金属元素
7.下列推断符合实际的有(??? )
A.第n周期的最后一种金属元素处在第n主族(n>1)
B.第n周期有8-n种非金属元素(n>1,包括稀有气体元素)
C.m=1和m=7的元素单质相互化合时,都形成离子化合物
D.m-n=5的主族元素存在最强的对应含氧酸;m-n=-5的元素对应的氧化物的水化物是最强的碱
参考答案:6. BC
7. A、B
本题解析:
本题难度:一般
5、填空题 (10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素
| H
| Li
| Be
| B
| C
| N
| O
| F
|
电负性
| 2.1
| 1.0
| 1.5
| 2.0
| 2.5
| 3.0
| 3.5
| 4.0
|
元素
| Na
| Mg
| Al
| Si
| P
| S
| Cl
| K
|
电负性
| 0.9
| 1.2
| 1.5
| 1.7
| 2.1
| 2.3
| 3.0
| 0.8
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:0.8< X <___________。
②写出K的基态原子的电子排布式:
K:_______________________________________
③根据表中的所给数据分析,同主族内的不同元素X的值变化的规律
是???????????????????????????????????????;?简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________。
参考答案:①F (2分)?? 0.8< X <1.2?(2分)②??K
本题解析:
本题难度:一般
|