微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子中能大量共存的是( )
A.H+,Ba2+,Cl-,CO32-
B.K+,Cl-,NO3-,Mg2+
C.NH4+,Na+,Cl-,OH-
D.SO42-,Ba2+,Cl-,NO3-
参考答案:A、因Ba2+、CO32-能结合生成沉淀,H+、CO32-能
本题解析:
本题难度:一般
2、选择题 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。
①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是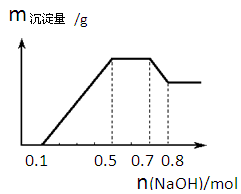
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2mol
C.溶液中一定不含CO32?,可能含有SO42?和NO3?
D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
参考答案:B
本题解析:
试题分析:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,其n(NH4+)=0.7mol-0.5mol=0.2mol;由于溶液中还必须存在阴离子,所以一定还有SO42?。根据题型可知,氢离子的物质的量时0.1mol、铝离子
本题难度:简单
3、选择题 下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH、Cl-、S2-
B.0.1 mol·L-1FeCl3溶液中大量存在Fe2+、NH、SCN-、SO
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO、Cl-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
参考答案:C
本题解析:
试题分析:A、铝离子与硫离子发生双水解生成氢氧化铝和硫化氢不能大量共存,错误;B、铁离子与SCN-发生络合反应不能大量共存,错误;C、碳酸氢铵及溶液中的离子都不反应,可以大量共存,正确;D、中性溶液中不可能存在大量铁离子,因为铁离子水解使溶液呈酸性,而其他离子都不发生水解,错误,答案选C。
考点:考查给定条件的离子的大量共存的判断
本题难度:一般
4、选择题 下列有关溶液的叙述正确的是
A.常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol·L-1
B.在pH=2的醋酸溶液中加入等体积c(酸)=2mol·L-1的某酸溶液后,混合溶液的pH一定会减小
C.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液的m倍和n倍,若稀释后两溶液的pH仍相同,则m>n
D.导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多
参考答案:A C
本题解析:常温下的醋酸铵溶液,铵根离子和醋酸根离子均会水解,它们分别水解得到的H+和OH-的浓度相等,故溶液呈中性,此时,由于水的离子积没变c(H+)=c(OH-)=10-7mol·L-1;B项中若加入的酸的酸性比醋酸还要弱,则有可能使溶液的pH增大;溶液的导电性取决于溶液中自由移动离子的浓度而非数目,D项错。
本题难度:一般
5、选择题 在下列透明溶液中,因氧化还原反应而不能大量共存的离子组是
A.Na+、K+、H+、S2―
B.Cl—、Al3+、OH―、Na+
C.Na+、CH3COO—、H+、K+
D.K+、I— 、Na+、Fe3+
、Na+、Fe3+
参考答案:D
本题解析:略
本题难度:一般