微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Na+、Mg2+、Cl-、SO42-
B.0.1 mol·L-1 NaHCO3溶液: Na+、Ba2+、NO3-、OH-
C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、I-
D.由水电离出的c(H+)=10-12mol·L-1的溶液:Na+、K+、NO3-、ClO-
参考答案:A
本题解析:
试题分析:A、使甲基橙变红色的溶液呈酸性,组内离子间不反应,能大量共存,正确;B、0.1 mol·L-1 NaHCO3溶液中,Ba2++OH-+ HCO3— BaCO3+H2O,不能大量共存,错误;C、滴加KSCN溶液显红色的溶液中含有Fe3+,2Fe3++2I-
BaCO3+H2O,不能大量共存,错误;C、滴加KSCN溶液显红色的溶液中含有Fe3+,2Fe3++2I- 2Fe2++I2,不能大量共存,错误;D、由水电离出的c(H+)=10-12mol·L-1的溶液既可能呈酸性又可能呈碱性,酸性条件下,H++ClO-
2Fe2++I2,不能大量共存,错误;D、由水电离出的c(H+)=10-12mol·L-1的溶液既可能呈酸性又可能呈碱性,酸性条件下,H++ClO- HClO,错误。
HClO,错误。
考点:考查离子共存问题。
本题难度:一般
2、选择题 室温下某无色透明溶液中由水电离出的H+和OH—浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为???????????????????????????????????????(???)?????????????????????????
A.HCO3-.Al3+.Na+.SO42-
B.I-.NO3-.K+.NH4+
C.MnO4-.Cl-.SO42-.K+
D.SiO32-.OH-.SO32-.Na+.Cl-
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下列各组离子中,能在碱性溶液中大量共存的是:
A.H+、Na+、Cl-、SO
B.K+、Na+、SO 、CO
、CO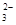
C.Cu2+、K+、Cl-、S2-
D.Ba2+、K+、CO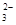 、HCO
、HCO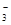
参考答案:B
本题解析:A选项中H+不能大量存在于碱性溶液当中。C选项中CU2+要与碱溶液中的OH-反应生成沉淀氢氧化铜。D选项中钡离子和碳酸根离子不能共存,其次碳酸氢根离子不能与碱性溶液中的氢氧根离子共存。因此应选择B
本题难度:一般
4、选择题 能在水溶液中大量共存的一组离子是
A.H+、I―、NO3―、SiO32-
B.Ag+、Fe3+、Cl―、SO42―
C.K+、SO42-、Cu2+、NO3―
D.NH4+、OH-、Cl-、HCO3-
参考答案:C
本题解析:本题考察离子共存问题。SiO32-属于弱酸硅酸的酸根与酸不能大量共存,同时在酸性溶液中,NO3―具有氧化性能氧化I―生成单质碘,A不正确;Ag+与Cl―和SO42―均可生成难溶性物质AgCl和Ag2SO4,B不正确;在碱性溶液中NH4+和HCO3-均与OH-结合分别形成氨水和CO32-,因此D也不正确,所以答案是C。
本题难度:一般
5、选择题 某澄清溶液中可能只含有以下离子中的若干种:Na+、Fe3+、Fe2+、SO42-、Cl-、
Ba2+、I-。现取部分溶液依次进行如下实验:
①通入一定量氯气后,加入CCl4振荡,静置后CCl4层呈紫红色,用分液漏斗分液;
②向分液后的水溶液中加入足量硝酸酸化的硝酸钡溶液,产生白色沉淀;
③过滤后将滤液分为两份,向一份中加入硝酸酸化的硝酸银溶液,产生大量沉淀,向另一份中加入少量KSCN溶液,溶液立即变为红色.根据上述实验,以下推测正确的是???????????
A.原溶液中肯定存在的离子有Fe3+、SO42-、I-
B.无法确定原溶液中是否存在Cl-、Na+
C.原溶液一定显中性
D.原溶液中肯定不存在的离子有Fe2+、Ba2+
参考答案:B
本题解析:
试题分析:①静置后CCl4层呈紫红色,则溶液中存在I-;②加入足量硝酸酸化的硝酸钡溶液,产生白色沉淀,则溶液中存在SO42-,而且一定不存在Ba2+;③加入硝酸酸化的硝酸银溶液,产生大量沉淀,则说明此时溶液中有Cl-,但因①中通入一定量的氯气,故无法判断原溶液中是否有Cl-;向另一份中加入少量KSCN溶液,溶液立即变为红色,说明此时溶液中有Fe3+,但因前面又加入硝酸,故无法判断原溶液中是Fe3+还是Fe2+。综上所述,原溶液中一定存在的离子有SO42-、I-,一定不存在的离子有Ba2+,无法确定
本题难度:一般