微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 加碘食盐中加入的碘酸钾是一种白色结晶粉末,其溶解度受温度影响很大,且随温度的升高而逐渐增大,常温下很稳定,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质发生反应。
(1)为检验某食盐中是否含有KIO3,某同学取食盐样品完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为________________;
(2)KIO3也可用电解的方法制得,其原理是以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则两极的电极反应式分别为:阴极___________,阳极
____________。
2、填空题 钛是一种重要的金属,工业上用钛铁矿(FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(
TiO2),TiO2常通过两种方法还原制得Ti。

已知:2H2SO4+FeTiO3==TiOSO4+FeSO4 +2H2O. 回答下列问题:
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH=Na2SiO3+ H2O和___。
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是___。
(3) TiOSO4是一种强酸弱碱盐。从TiOSO4→H2TiO3需要加热,则加热的目的是____。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽。其阴极反应的电极反应式为___。
(5)因为反应TiO2(s)+2Cl2(g)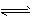 TiCl4(l)+O2(g) △H=+151 kJ.mol-1难于发生,所以工业上不能直接由TiO2和
TiCl4(l)+O2(g) △H=+151 kJ.mol-1难于发生,所以工业上不能直接由TiO2和
Cl2反应来制取TiCl4。当反应体系中加入炭粉后,反应分如下两步进行:
2C(s) +O2 ( g)=2CO( g) △H1= -221 kJ . mol-1
TiO2(s) +2C(s) +2Cl2(g)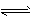 TiCl4 (l) +2CO( g) △H2 则△H2=____。
TiCl4 (l) +2CO( g) △H2 则△H2=____。
3、填空题 (1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下
CH4(g)+1/2O2(g) CO(g)+2H2(g);△H= -36kJ/mol ①
CO(g)+2H2(g);△H= -36kJ/mol ①
CH4(g)+H2O(g)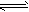 CO(g)+3H2(g);△H= +216kJ/mol ②
CO(g)+3H2(g);△H= +216kJ/mol ②
①下列说法正确的是_________。
A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6∶1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol 时,假定只发生反应CH4(g)+H2O(g)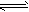 CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为__________。
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为__________。
(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的
Fe3O4:
3Fe+NaNO2+5NaOH3 Na2FeO2+H2O+NH3↑ ①;
Na2FeO2+H2O+NH3↑ ①;
8Fe+3NaNO3+5NaOH+2H2O 4Na2Fe2O4+3NH3↑ ②;
4Na2Fe2O4+3NH3↑ ②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平:______________________。
(3)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应:_________________。
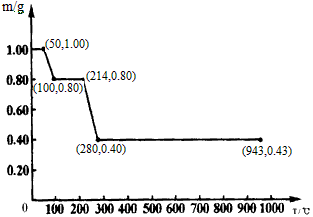
(4)将固体草酸锰MnC2O4·2H2O放在一个可以称出质量的容器里加热。固体质量随温度的变化关系如下图所示(质量单位为g):则214℃时,剩余固体的成分为____________。(填化学式);在280℃时,剩余固体的成分为____________。(填化学式)
4、填空题 开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 molO3转化为1 molO2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是 ____。(填序号)
A.Cl2
B.H2O2
C.ClO2
D.O3
(2)氯氨(NH2Cl)可作为杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理:___
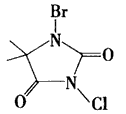
(3)氯溴海因(C5H6 BrClN2O2)是一种比较安全的氯气和氯制剂的替代产品,其结构式如下图所示: 氯溴海因在水中的水解过程比较复杂,主要是水解生成次卤酸和海因,请画出海因的结构式:___。?
(4)以铂(Pt)和铁为电极,以KOH溶液为电解液,用电解法可制备高铁酸钾 (K2FeO4)。写出阳极的电极反应式:____。
5、填空题 某市生产的新型净水剂高铁酸钠价格低,质量高,备受用户好评。高铁酸钠(Na2FeO4)易溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备Na2FeO4的常用方法主要有氧化法和电解法。
方法一:氧化法。
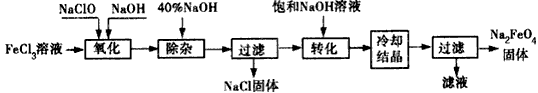
(1)配平下列化学方程式:
①____FeCl3+___NaOH+___NaClO→ ___Na2FeO4+____+____,
②其中氧化剂是___________(填化学式)。
(2)上述工艺得到的高铁酸钠常含有杂质,可用重结晶法提纯,操作是:将粗产品用稀NaOH溶液溶解,然 后__________________。
方法二:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入NaOH。
(3)电解时阳极发生反应生成FeO42-,该电极反应方程式为_______________。