微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 石墨-锌电池的电极反应为:锌片:Zn + 2OH- -2e- = ZnO + H2O 石墨:O2 + 2H2O +4e- = 4OH-,据此判断,锌片是[???? ]
A. 负极,并被氧化
B. 负极,并被还原
C. 正极,并被氧化
D. 正极,并被还原
参考答案:A
本题解析:
本题难度:简单
2、选择题 铅蓄可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:2PbSO4+2H2O═Pb+PbO2+2H2SO4,下列判断不正确的是( )
A.其充电过程作为电解池,放电过程作为原电池
B.放电时,Pb作为负极
C.放电时,PbO2发生还原反应
D.充电时,PbSO4在阴极转化为PbO2
参考答案:A:铅蓄可充电电池,充电过程是把电能转化成化学能,是电解池;
本题解析:
本题难度:简单
3、填空题 按下列要求自制铜-镁简易电池,并回答有关问题。
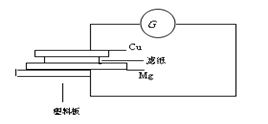
a.用砂纸擦净一块铜片和镁条。
b.用盐酸溶液浸湿一张滤纸,把浸湿的滤纸放在镁条上。
c.把滤纸和镁条并放在一块塑料板上。
d.把镁条连接到电流计的一个端钮
e.把铜片压在滤纸上。
f.把铜片连接到电流计的另一个端钮。
g.观察电流表指针变化。
请回答下列问题。
(1)在以上简易电池中, 是负极,电极反应式
是正极,电极反应式
(2)在以上电池中,电子由 经 流向
参考答案:(1) Mg Mg -
本题解析:
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。镁的金属性强于铜,则镁是负极,失去电子,电极反应式是Mg - 2e- = Mg2+;铜是正极,溶液中的氢离子得到电子,电极反应式是2H+ + 2e_ = H2↑。
(2)该原电池中,电子由负极(或镁极板)经导线或外电路或电流计流向正极(或铜极板)。
考点:考查原电池应用的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
4、判断题 (12分)市场出售的“热敷袋”,其主要成分是铁屑、炭粉、木屑与少量氯化钠、水等。它在使用之前需用塑料袋与空气隔绝。使用时开启塑料袋的小气孔,轻轻揉搓就会放出热量来。当使用完后还会发现有锈生成,依上述现象完成下列问题:
(1)“热敷袋”放出热量使铁发生了什么反应?
(2)炭粉的主要作用是什么?
(3)加入氯化钠的作用是什么?
(4)写出有关的电极反应与化学方程式来表明上述过程。
参考答案:(1)铁是原电池的负极,发生了氧化反应,Fe-2e-====
本题解析:“热敷袋”利用原电池的工作原理,铁发生氧化反应放出能量。在此原电池中,Fe作负极,炭粉作正极,NaCl和水构成电解液,Fe发生吸氧腐蚀。
本题难度:简单
5、填空题 (12分)按下图装置进行实验,并回答下列问题

(1)判断装置的名称:A池为___________ , B池为______________
(2)锌极为__________极,电极反应式为_______________??????__________
(3)石墨棒C1为______极,电极反应式为__________????????_____________
石墨棒C2附近发生的实验现象为________________????????____________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。
参考答案:(12分)
(1)原电池,电解池
(2)负???
本题解析:略
本题难度:简单