微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图A所示,则该反应的ΔH 0(填“>”、“<”或“=”)。

③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图B所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” 或“<”)。
(3)以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比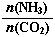 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
参考答案:(1)Fe2O3(s)+3CO(g) = 2Fe(s)+3C
本题解析:
试题分析:(1)根据已知方程式和盖斯定律,所求方程式可由①-②×3得,△H = △H 1-3△H 2 =" +489.0" kJ·mol-1-3×172.5 kJ·mol-1 =—28.5 kJ·mol-1 ,所以CO还原氧化铁的热化学方程式为:Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H = —28.5 kJ·mol-1 。
(2)①根据给出的热化学方程式可得出该反应的平衡常数表达式为:K= 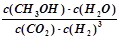 ,
,
②图A中生成物甲醇的体积分数随着温度升高呈现出先增大后减小的变化,可以分析为达到最高点之前反应并未达到平衡,随温度升高反应速率加快,甲醇含量不断增大;当达到一定值时,反应达到平衡,此时再升高温度平衡发生移动,甲醇含量下降可以看出平衡逆向移动,所以该反应正反应为放热反应,ΔH<0。
③图B中不同条件下反应达到平衡时得到的甲醇的物质的量I>Ⅱ,所以I条件下的反应进行程度更大,所以KⅠ>KⅡ 。
(3)①工业用CO2和NH3在一定条件下合成尿素,该反应方程式可以由C:N比进行配平,所以方程式为: 2NH3+CO2 CO(NH2)2+H2O;根据方程式中的系数可知,反应的n(NH3)=2n(CO2),而总的n(NH3)=3n(CO2),所以假设的CO2有1mol,则有n(NH3)=3n(CO2)=3mol,反应的n(NH3)=2×1×0.6 =1.2mol所以氨气的平衡转化率为40%。
CO(NH2)2+H2O;根据方程式中的系数可知,反应的n(NH3)=2n(CO2),而总的n(NH3)=3n(CO2),所以假设的CO2有1mol,则有n(NH3)=3n(CO2)=3mol,反应的n(NH3)=2×1×0.6 =1.2mol所以氨气的平衡转化率为40%。
②在酸性电介质中发生电解反应,考虑氢离子参加反应,CO2在电极上得电子被还原为甲烷,有水生成,所以电极反应式为:CO2+8e—+8H+=CH4+2H2O。
考点:本题考查的是化学反应原理的知识,主要涉及热化学方程式的书写、盖斯定律的应用、平衡常数的表达、焓变的大小判断、平衡图像的理解等知识。
本题难度:困难
2、填空题 (15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
元素
| A
| B
| C
| D
| E
|
相关
信息
| 最高正价与最低负价代数和为2
| 与元素C可形成离子个数比为2:1和1:1的化合物
| 单质质软,通常保存在煤油中
| D元素可形成两种氧化物,其中一种是形成酸雨的主要成分
| 其单质是用途最广泛的金属,人体缺少该元素易患贫血症
回答以下问题(化学用语中的元素用相应的元素符号表示)。
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
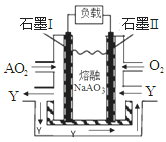
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。
参考答案:(1)第三正确第IA族 (2)>
(3)取少量的样品于
本题解析:
试题分析:A最高正价与最低负价代数和为2,则A是第ⅤA族元素,且A的原子序数最小,所以A是氮元素。C单质质软,通常保存在煤油中,则C是钠元素。B与元素C可形成离子个数比为1:2和1:1的化合物,则在短周期中符合条件的是氧化钠和过氧化钠,则B是氧元素。D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,因此D是硫元素。E单质是用途最广泛的金属,人体缺少该元素易患贫血症,且E不是短周期元素,所以E是铁。
(1)钠的原子序数是11,在元素周期表中的位置是第三正确第IA族。
(2)非金属性越强,氢化物的稳定性越强,氧元素的非金属性强于硫元素,则B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B>D。
(3)检验铁离子的方法是取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子。
(4)二氧化硫能使品红溶液褪色,因此鉴别D的两种氧化物的试剂是品红溶液;常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,则生成32g硫放出的热量是14.86kJ×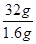 =297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。 =297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。
(5)硫化钠溶于水,硫离子水解溶液显碱性,则0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
(6)根据装置图可知,氧气通入的电极应该是正极,得到电子,则电极I是负极,二氧化氮失去电子,其氧化产物Y应该是N2O5,所以根据电解质是熔融NaNO3可知电极Ⅱ的反应式是O2+2N2O5+4e-=4NO3-。
考点:考查元素推断、元素周期律、铁离子和二氧化硫检验、热化学方程式、水解以及电极反应式书写
本题难度:困难
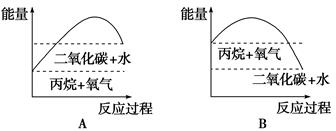
3、选择题 已知H2(g)+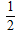 O2(g)═H2O(l)△H=-285.8kJ/mol.下列说法不正确的是( ) O2(g)═H2O(l)△H=-285.8kJ/mol.下列说法不正确的是( ) A.H2的燃烧热为285.8?kJ/mol
B.2H2(g)+O2(g)═2H2O(l)△H=-571.6?kJ/mol
C.1?mol?H2完全燃烧生成气态水放出的热量大于285.8?kJ
D.形成1?mol?H2O的化学键释放的总能量大于断裂1?mol?H2和0.5?mol?O2?的化学键所吸收的总能量
参考答案:C
本题解析:
本题难度:一般
4、选择题 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是[???? ]
A.CH3OH(l)+3/2O2(g)== CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)== 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
参考答案:B
本题解析:
本题难度:一般
5、填空题 (5分)(1)已知1 g丙烷完全燃烧生成气态水,放出的热量是47 kJ,又知:
H2O(l)== H2O(g) ΔH=+ 44 kJ·mol-1,则表示丙烷燃烧热的热化学方程式为
(2)下图中能较准确地反映丙烷燃烧时能量变化的曲线是________。
(3)已知在298K时下列反应的反应热为:
①CH3COOH(l) + 2O2(g)=2CO2(g)+2H2O (l)△H1=-870.3KJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
③H2(g)+1/2O2(g)=H2O (l) △H3=-285.8KJ/mol
则反应:2C(s) +2H2(g) +O2(g)=CH3COOH(l)的反应热
△H= KJ/mol
参考答案:(1) 本题解析:(1)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。根据题意可知,1mol丙烷完全燃烧生成4mol气态水,放出的热量是47kJ×44=2068kJ。而4mol气态水变成液态水又放出44kJ×4=176kJ,所以丙烷的燃烧热是(2068+176)kJ/mol=2224kJ/mol,因此热化学方程式为 本题解析:(1)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。根据题意可知,1mol丙烷完全燃烧生成4mol气态水,放出的热量是47kJ×44=2068kJ。而4mol气态水变成液态水又放出44kJ×4=176kJ,所以丙烷的燃烧热是(2068+176)kJ/mol=2224kJ/mol,因此热化学方程式为
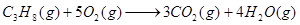 △H=-2224kJ/mol △H=-2224kJ/mol
(2)因为是放热反应,所以反应物的总能量高于生成物的总能量,因此答案选B。
(3)考查盖斯定律的应用,根据已知反应可知②×2+③×2-①即得到2C(s) +2H2(g) +O2(g)=CH3COOH(l),所以反应热是-393.5KJ/mol×2-285.8KJ/mol×2+870.3KJ/mol=--488.3kJ/mol。
本题难度:一般
|