微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.1mol羟基与17gNH3所含电子数都为NA
B.12.4g白磷(分子式为P4)中含有P—P共价键0.6 NA
C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
D.适量铜粉溶解于1L0.5mol·L-1稀硝酸中,当生成2.24LNO时,溶液中氮原子数为0.4 NA
参考答案:B
本题解析:A:羟基—OH中含有9个电子,NH3分子中10个电子,故1mol羟基与17gNH3(1mol)所含电子数都为9NA和10NA
B:白磷为空心正四面体结构分子,分子中含有6个P—P共价键,故12.4g白磷中含有P—P共价键为 0.6 NA,正确
0.6 NA,正确
C:由于阳极含有部分杂质金属也同时在溶解失电子,故阳极溶解
本题难度:一般
2、填空题 现用98%的浓H2SO4( =1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)请将下列操作按正确的序号填在横线上:
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确顺序为_____________
(2)简要回答下列问题:
①所需浓H2SO4的体积为________mL。
②如果实验室有15mL, 20mL, 25mL的量筒,选用_______mL的量筒最好。量取时发现量筒不干净,用水洗净后直接量取将使实验最终结果______(填“偏高”、“偏低”或“无影响”)。
③将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是_______,若搅拌过程中有液体溅出,会使最终结果_______(填“偏高”、“偏低”或“无影响”)。
④在转入容量瓶前烧杯中液体应_______,否则会使浓度_______;洗涤烧杯2~3次,洗液也要转入容量瓶,否则会使最终结果_______(填“偏高”、“偏低”或“无影响”)。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使结果_______,仰视会使结果_______(填“偏高”、“偏低”或“无影响”)。
参考答案:(1)AEFDCB;(2)①13.6?②15?偏低?③防止暴
本题解析:
试题分析:(1)本题考查一定物质的量浓度溶液配制的操作步骤;操作步骤有计算、量取、溶解、移液、洗涤、定容、摇匀等操作,其操作正确顺序为AEFDCB;(2)①根据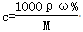 计算浓H2SO4的物质的量浓度为18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4m
计算浓H2SO4的物质的量浓度为18.4mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4m
本题难度:一般
3、实验题 (8分)准确称取12 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:
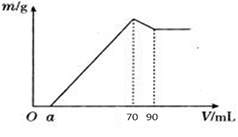
请填空回答:
(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=4.6,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各成分的质量分数:Al2O3为______________, SiO2为______________。
参考答案:(1)3.5 mol?L-1 (2)5.4 mL&
本题解析:
试题分析:Oa段意味着H2SO4过量,到70 mL时的沉淀最多,有Al(OH)3、Fe(OH)3沉淀,到90 mL时仅剩下Fe(OH)3沉淀。加入20 mL、10 mol·L-1 NaOH,把Al(OH)3↓全部转化成AlO2- 。(1)70 mL时沉淀最多,溶液为Na2SO4溶液,据电荷守恒,n(Na+)=2n(SO42- )。又据元素守恒,n(Na+)="n(NaOH)=10" mol·L-1×0.07 L="0.7" mol,n(SO42-)=n(H2SO4 )=c(H2SO4 )×0.1,所以c(H2SO4 )=3.5 mol?L-1
(2)沉淀Al3+消耗OH-的量,是使Al(OH)3溶解消耗OH-的3倍,即沉淀Al3+消耗NaOH为60 mL,若a=4.6,用于沉淀Fe3+消耗NaOH的体积是70-60-4.6="5.4" mL.
n(Al2O3 )="1/2n(NaOH)=1/2×(10" mol·L-1×0.02 L)="0.1" mol m(Al2O3 )="0.1" mol×102 g/mol="10.2" g
Al2O3的质量分数为=10.2/12×100%=85%,沉淀铁离子消耗NaOH的物质的量为10×0.0054=0.054moL,根据Fe3++3OH-=Fe(OH)3,铁离子的物质的量为0.018moL,Fe2O3的质量分数为[(0.009×160)÷12]×100%=12%,SiO2的质量分数为3%。
考点:考查铝、铁及其化合物的有关计算。
本题难度:一般
4、选择题 NA代表阿伏加德罗常数。下列说法中,不正确的是
A.标准状况下,NO和 O2各11.2 L混合,所得混合气体的分子总数为 0.75 NA
B.25℃时,l L pH=13的Ba(OH)2溶液中含有OH―的数目为0.1 NA
C.1 mol C30H62分子中含有共价键的数目为 91 NA
D.2.8g乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
参考答案:A
本题解析:A错,因为发生反应为2NO+O2=2NO2? , 2NO2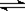 N2O4,所得混合气体的分子总数小于 0.75 NA;B正确,pH=13,则C(OH-)=0.1mol.L-1, l L溶液中含有OH―的数目为0.1 NA;C正确,因为每个C形成4个价键,每个H形成1个价键,每个价键被两个原
N2O4,所得混合气体的分子总数小于 0.75 NA;B正确,pH=13,则C(OH-)=0.1mol.L-1, l L溶液中含有OH―的数目为0.1 NA;C正确,因为每个C形成4个价键,每个H形成1个价键,每个价键被两个原
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列说法正确的是(??? )
A.0.2 mol H2O2完全分解转移的电子数为0.4 NA
B.1molCl2与1mol Fe反应,转移的电子数为3NA
C.在标准状况下,Cl2和H2的混合气22.4L,光照后原子总数为2NA
D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA
参考答案:C
本题解析:
试题分析:A不正确,双氧水中氧元素的化合价是-1价,0.2 mol H2O2完全分解转移的电子数为0.2N;B不正确,铁是过量的,转移2mol电子;氢气、氯气、氯化氢都是2个原子构成的,C正确;D不正确,因为不是在标准状况下,答案选C。
点评:阿伏加德罗常数是历年高考的“热点”问题。考查阿伏加德罗常数的应用的题目,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以
本题难度:一般