微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体
(CuCl2?2H2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
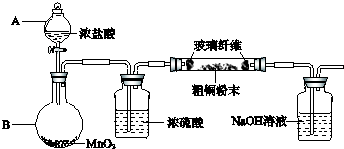
①仪器A的名称是______.
②装置B中发生反应的离子方程式是______.
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)______.
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)______.
a.NaOH???b.NH3?H2O???c.CuO???d.Cu2(OH)2CO3???e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:Cu(H2O)42+(aq)+4Cl-(aq)?

????CuCl42-(aq)+4H2O(l)
?????????????????????????????????????????蓝色??????? ??????? ????????????????????黄色
①上述反应的化学平衡常数表达式是K=______.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)______.
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)______.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.
参考答案:(1)①仪器A是分液漏斗.
故答案为:分液漏斗.
本题解析:
本题难度:一般
2、选择题 化学学科的发展对人类文明进步起到了极为重要的作用.下列认识正确的是( )
A.人类对金、银、铜、铁、铝的认识与其在自然界分布无关
B.人类解决吃、穿、住、行最有效的方法就是大力开发石油及其产品
C.工业上可用电解熔融态的MgCl2、AlCl3来制备Mg、Al
D.工业上可用空气、Cu、稀硫酸来制备CuSO4
参考答案:D
本题解析:
本题难度:一般
3、选择题 当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成深蓝色溶 液。向深蓝色溶液中通入SO2气体,又生成了白色沉淀。将白色沉淀加入稀硫酸中,又生成了红色粉末 状固体和SO2气体,同时溶液呈蓝色。根据上述实验现象分析推测,下列描述正确的是 [???? ]
A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下发生了自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
参考答案:AC
本题解析:
本题难度:一般
4、填空题 Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,______,然后研细;⑤检查④中洗涤是否完全的操作是______.
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据
a
15mL
无
b
15mL
0.5g?CuO
c
15mL
0.5g?MnO2
①从设计原理看,实验中的待测数据是______.
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.______.
Ⅱ.摩尔盐[(NH4)2SO4-FeSO4-6H2O]
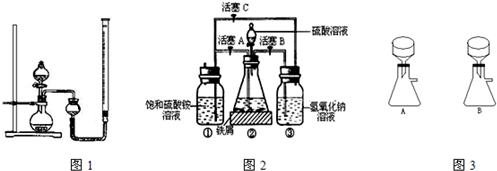
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞______,打开活塞______(填字母).向容器①中通人氢气的目的是______.
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是______.(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol-L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO?
-4
+5Fe2++8H+=Mn2++5Fe3++4H2O
试求产品中摩尔盐的质量分数______.(NH4)2SO4-FeSO4-6H2O的相对分子质量为392.
参考答案:Ⅰ.(1)④、混合物过滤,洗涤,干燥后才能研细;
故答
本题解析:
本题难度:一般
5、选择题 在某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L.向其中加入1.92克铜粉微热,待充分反应后,溶液中的Cu2+物质的量浓度为( )
A.0.15mol/L
B.0.3mol/L
C.0.225mol/L
D.无法计算
参考答案:B
本题解析:
本题难度:一般
|