微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在?NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2.如果混合液中共有0.5mol?Cl-,溶液的体积为0.5L,则混合液中氯化钠的质量为______;MgCl2的物质的量浓度为______.
参考答案:NaCl与MgCl2的混合液中共有0.5mol?Cl-,根据
本题解析:
本题难度:一般
2、计算题 将50.0g含有NH4NO3、(NH4)2SO4及其它难溶物的混合物样品,溶于水,过滤后加入足量浓NaOH溶液共热,在标准状况下收集到13.44 L氨气,再向溶液中加入足量BaCl2溶液,产生沉淀46.6g,试计算混合物中NH4NO3的物质的量及(NH4)2SO4的质量分数。
参考答案:n(NH4NO3)=0.2mol,w((NH4)2SO4)=
本题解析:
试题分析:加入氯化钡产生沉淀,则说明这个沉淀是硫酸钡,即硫酸钡的质量为46.6克。则它的物质的量为46.6除以233等于0.2mol.再由原子个数守恒可知(NH4)2SO4的物质的量等于BaSo4 物质的量所以(NH4)2SO4为0.2mol 。再由质量等于物质的量乘以摩尔质量可求出硫酸铵的质量为0.2乘以132等于26.4克,.所以硫酸铵的质量分数为26.4除以50.5等于52.8%
由氮元素个数守恒可知;(NH4)2SO4---2NH3 由 (NH4)2SO4生成氨气的物质的量为0.4mol
而总得氨气的物质的量为13.44除以22.4等于0.6mol 所以由硝酸铵制备得的氨气的物质的量为0.6减去0.4等于0.2mol,据氮原子个数守恒可知硝酸铵的物质的量为0.2mol
考点:考查物质的量在化学反应中计算的相关知识点
本题难度:一般
3、选择题 NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,2.24L H2O含有的分子数等于0.1NA
B.常温下,100ml 1 moI·L-1Na2CO3溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4g NH3中含N—H键数目为0.2NA
参考答案:B
本题解析:标准状况下1mol任何气体(包括不反应的混合气体)所占体积约为22.4L,水在标准状况下为冰水混合物,A错;常温下,100ml 1 moI·L-1Na2CO3物质的量为1mol,由于CO32-会发生水解,溶液中阴离子总数大于0.1NA,B正确;C错,不是在标准状况下。1 moINH3中含3molN—H,3.4g NH3物质的量为0.2moI,N—H键数目为0.6NA
本题难度:简单
4、选择题 若阿伏加德罗常数的数值用NA表示,下列说法正确的是
A.标准状况下,1.12L氦气所含原子数为0.1NA
B.1.6gNH2- 离子所含质子数为NA
C.22.4 LHCl溶于水,溶液中H+数为NA
D.9g D216O所含的中子数为4.5 NA
参考答案:D
本题解析:标准状况下,1.12L氦气的物质的量是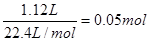 ,但氦气是单原子分子,所以含有的原子数是0.05NA,A不正确。NH2- 离子所含质子数为7+2=9,1.6gNH2- 的物质的量是
,但氦气是单原子分子,所以含有的原子数是0.05NA,A不正确。NH2- 离子所含质子数为7+2=9,1.6gNH2- 的物质的量是
本题难度:一般
5、选择题 .NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2固体中含离子总数为4 NA
D.标准状况下,2.24L甲烷所含共价键数为0.1 NA
参考答案:B
本题解析:等物质的量并没有指清楚是多少,等物质的量的N2和CO所含分子数相等,只有当都是1mol时分子数才都是NA,A错误;一个H2O2中含有的电子数是18个,1.7g H2O2恰好为0.05mol,所以所含的电子数为 ,B正确;根据Na2O2的电子式
,B正确;根据Na2O2的电子式 本题难度:一般
本题难度:一般