微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表是部分短周期元素的原子半径及主要化合价.
| 元素代号 | L | M | Q | R | T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
以下叙述正确的是( )
A.气态氢化物的稳定性为H2T<H2R
B.M和T能形成一种极有前途的高温结构陶瓷
C.单质与稀盐酸反应的速率为L<Q
D.L2+与R2-的核外电子数相等
参考答案:元素的最高正价+|最低负价|=8,同周期元素的原子从左到右原
本题解析:
本题难度:一般
2、选择题 下列递变规律正确的是( )
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的还原性依次增强
C.Al3+、Mg2+、F-粒子的半径依次减小
D.K、Rb、Cs最高正价依次降低
参考答案:A、非金属性Cl>S>P,对应最高价氧化物的水化物的酸性HC
本题解析:
本题难度:一般
3、填空题 看表填空。
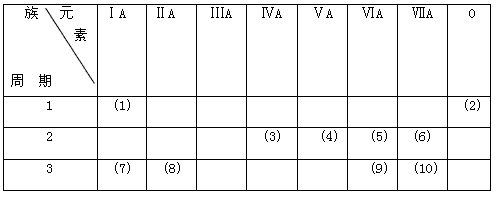
(A) (1)、(5)、(9)号元素,相互化合时可形成两种常见_______化合物,但溶于水后都可以电离出相同的_______离子。
(B)(8)、(10)号元素化合时,可通过_______键形成_______化合物。
(C)(1)、(5)、(7)号元素相互化合形成的物质中,既有_______键,又有_______键。
参考答案:A 共价; 氢
B离子; 离子
C离子; 共
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数比其次外层电子数多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:?
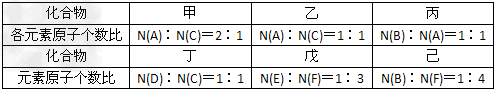
请回答下列问题:
(1)化合物己的电子式___________。
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为_________?mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为__________。
(4)F的单质与甲反应的离子方程式为____________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为_____________。
参考答案:(1)![]() 本题解析: 本题解析:
本题难度:一般
5、选择题 X、Y、Z三种元素原子的核电荷数在11—17之间。它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4。则下列判断不正确的是
A.最高正价:X>Y>Z
B.酸性:H3ZO4>H2YO4>HXO4
C.稳定性:HX>HY>HZ
D.非金属性:X>Y>Z
参考答案:B
本题解析:根据最高价氧化物对应水化物的化学式可得出X、Y、Z的最高正价分别是+7价、+6价和+5价,即它们分别属于第ⅦA、第ⅥA和第ⅤA,非金属性之间减弱,需要氢化物的稳定性也之间减弱,所以不正确的选项是B。答案B。
本题难度:困难
|