微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图8-4,当阴极增重2.16g时,下列判断正确的是??????????
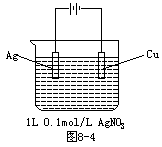
A.[AgNO3]=0.08mol/L
B.阳极产生112mL气体(标况)
C.有1.204×1023个电子转移
D.反应中有0.02mol物质被氧化
参考答案:D
本题解析:此装置为电镀池:
阳极:Ag-e=Ag+;阴极(Cu):Ag++e=Ag,所以阴极增重的2.16g为

个,所以C错误。
本题难度:一般
2、选择题 在盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后( )
A.溶液的pH增大
B.Na+和CO32-的浓度减小
C.溶液的浓度增大
D.溶液的浓度不变,有晶体析出
参考答案:盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电时
本题解析:
本题难度:一般
3、实验题 (14分 每空2分)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:
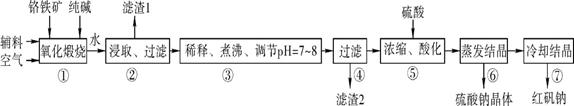
步骤①中主要反应的化学方程式如下:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 。
(2) 杂质Al2O3在①中转化的化学反应方程式为 。
(3) 用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4) ⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式: 。
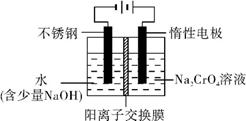
(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如上。
阴极的电极反应式为 ;
阳极的电极反应式为 。
参考答案:(14分 每空2分) (1) 增大反应物的接触面积
本题解析:
试题分析:(1) 固体反应物在搅拌时,可以与氧气充分接触,增大接触面积,使反应速率加快;
(2)氧化铝与碳酸钠在高温条件下发生反应,生成偏铝酸钠和二氧化碳,化学方程式为Al2O3+Na2CO3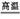 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(3)氧化煅烧再溶于水,所得溶液中有偏铝酸钠、硅酸钠、铬酸钠,其中AlO2-、SiO32-水解,水解吸热,煮沸促进水解平衡AlO2-+2H2O Al(OH)3+OH-、SiO32-+2H2O
Al(OH)3+OH-、SiO32-+2H2O H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀;若溶液pH过低,则生成的氢氧化铝沉淀又溶解生成Al3+,杂质Al3+与Na2CrO4难以分离;
H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀;若溶液pH过低,则生成的氢氧化铝沉淀又溶解生成Al3+,杂质Al3+与Na2CrO4难以分离;
(4)酸性条件下CrO42-转化为Cr2O72-,该反应是可逆反应,离子方程式为2CrO42-+2H+ Cr2O72-+H2O;
Cr2O72-+H2O;
(5)电解池中阴极是阳离子放电,根据离子的放电顺序,应是氢离子放电,所以电极反应式为4H2O+4e- 4OH-+ 2H2↑;或2H++2e-= H2↑;阳极是阴离子放电,所以是氢氧根离子放电,电极反应式为4OH--4e-
4OH-+ 2H2↑;或2H++2e-= H2↑;阳极是阴离子放电,所以是氢氧根离子放电,电极反应式为4OH--4e- O2↑+2H2O。
O2↑+2H2O。
考点:考查物质制备,涉及反应速率、化学方程式、离子方程式、电极反应式的判断与书写
本题难度:困难
4、选择题 根据金属活动性顺序,Ag不能发生反应:2HCl+2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下图所示的四组电极和电解液中,为能实现该反应最恰当的是[???? ]
A.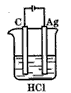
B.
C.
D.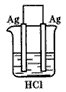
参考答案:C
本题解析:
本题难度:一般
5、选择题 用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是
A.AgNO3
B.Na2SO4
C.CuCl2
D.H2SO4
参考答案:BD
本题解析:考查电解产物的判断。向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度。说明电解的物质是水,因此选项BD正确。A中硝酸银也被电解,有关加入氧化银;C中氯化铜全部被电解,有关加入氯化铜,答案选BD。
本题难度:一般