微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)3 mol KClO3完全分解,生成氧气的物质的量为 mol,其质量为 g。
(2) mol Zn和足量的HCl反应,生成氢气1.5 mol。
(3)与5.1 g某二元酸H2R完全反应,刚好消耗NaOH的质量为12 g,则H2R的摩尔质量为 。
参考答案: (1)4.5 144 (2)1.5 (3)34 g·mol
本题解析:
试题分析:此3小题均为物质的量在化学方程式中的简单计算。将物质的量运用于方程式计算时,一定要明确物质的量与化学方程式的化学计量数间的关系,即化学计量数之比等于物质的量之比。
(1)反应式为2KClO3 2KCl+3O2↑,表示2 mol KClO3完全分解,生成3 mol氧气,若有3 mol KClO3完全分解,则生成4.5 mol氧气。此过程可列式如下:
2KCl+3O2↑,表示2 mol KClO3完全分解,生成3 mol氧气,若有3 mol KClO3完全分解,则生成4.5 mol氧气。此过程可列式如下:
2KClO3 2KCl+3O2↑
2KCl+3O2↑
2 mol 3 mol
3 mol n(O2)
n(O2)=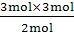 =4.5 mol,
=4.5 mol,
m(O2)=4.5 mol×32 g·mol-1="144" g。
(2)解题过程为
Zn+2HCl====ZnCl2+H2↑
1 mol 1 mol
n(Zn) 1.5 mol
n(Zn)=1.5 mol。
(3)本小题要求H2R的摩尔质量,需知道H2R的物质的量,而H2R的物质的量要根据与NaOH的反应来确定。解题过程为n(NaOH)=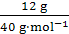 =0.3 mol。
=0.3 mol。
H2R + 2NaOH====Na2R+2H2O
1 mol 2 mol
n(H2R) 0.3 mol
n(H2R)=0.15 mol,
M(H2R)=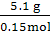 ="34" g·mol-1。
="34" g·mol-1。
考点:物质的量的计算、化学方程式计算。
本题难度:一般
2、填空题 (8分)3.01×1023个HCl分子的物质的量是 ,摩尔质量是 ,其在标准状况下的体积为 ,将其溶于水配成1L溶液,所得溶液的物质的量浓度为 。
参考答案:0.5mol
本题解析:略
本题难度:一般
3、选择题 相同质量的下列气体,在同温同压下占有的体积最大的是
A.H2
B.O2
C.Cl2
D.SO2
参考答案:A
本题解析:
试题分析:根据V=n×Vm,n=m/M,知道质量相同的时候摩尔质量越大体积越小,故选A。
考点:有关物质的量的公式的运用。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是??????
A.常温常压下,NO2和N2O4的混合物46g中含有2NA个氧原子
B.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
C.10mL98%的浓H2SO4用水稀释至l00mL,H2SO4的质量分数为9.8%
D.标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L
参考答案:A
本题解析:
试题分析:NO2和N2O4的最简式相同,只需要计算46g NO2中氧原子数=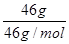 ×2×NA=2NA,故A正确;不是标况下,无法计算氯气的物质的量,故B错误;98%的浓硫酸密度是1.84克/毫升,10毫升是18.4克,含硫酸18.03克,稀释到100毫升溶液不是100克,但是不到184克,所以质量分数大于9.
×2×NA=2NA,故A正确;不是标况下,无法计算氯气的物质的量,故B错误;98%的浓硫酸密度是1.84克/毫升,10毫升是18.4克,含硫酸18.03克,稀释到100毫升溶液不是100克,但是不到184克,所以质量分数大于9.
本题难度:一般
5、计算题 (6分)在250mlKI溶液中通入一定量的Cl2,再将所得溶液蒸干,并加热到质量不再减少为止,称得固体质量为23.2g,经实验分析所得固体中含碘27.37%,试计算:
⑴原KI溶液的物质的量浓度是多少?
⑵参加反应的Cl2有多少升(标准状况)?
参考答案:⑴原KI溶液的物质的量浓度为1mol/L
⑵参加反应的
本题解析:
试题分析:氯气与碘化钾反应生成碘单质和氯化钾,而加热后碘单质挥发,
故27.37%是碘离子的质量分数,
由此可得碘化钾质量23.2g?27.37%?127?166=8.3g,所以氯化钾为14.9g,
又由于每166g碘化钾生成74.5g氯化钾,
故所有氯化钾由33.2g碘化钾生成,
即原有碘化钾41.5g即0.25mol,原KI溶液的物质的量浓度为0.25mol?0.25L=1mol/L。
因为氯化钾14.9g即0.2mol,所以有0.1mol氯气参加反应,即2
本题难度:一般