微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
实验编号
| KClO3(g)
| 氧化物
| 产生气体(mL)(已折算为标况)
| 耗时(s)
|
化学式
| 质量(g)
| 实际回收
|
1
| 0.6
| —
| —
| —
| 10
| 480
|
2
| 0.6
| MnO2
| 0.20
| 90%
| 67.2
| 36.5
|
3
| 0.6
| CuO
| 0.20
| 90%
| 67.2
| 79.5
|
4
| 0.6
| Fe2O3
| 0.20
| 90%
| 67.2
| 34.7
|
5
| 0.6
| Cr2O3
| 0.20
| 异常
| 67.2
| 188.3
|
?
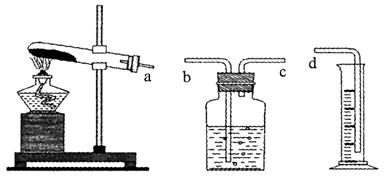
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为????????????????????????????。
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→???????????????????????????????????????。
(3)写出实验室中通过编号2制取氧气的化学方程式:????????????????????????????????????
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为?????(填物质的化学式)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是??????(填化学式),可用?????????????????????????????????????试纸检验该气体,上述异常现象产生的原因是????????????????????????????????????????????。
参考答案:(1)a→c→b→d(2分)
(2)过滤→洗涤→干燥→
本题解析:
试题分析:(1)根据排水法测气体体积的进气方式为:短管进气长管出水,所用连接顺序为a→c→b→d。
(2)MnO2难溶于水,测定反应剩余物MnO2的质量,要溶解、过滤、洗涤、干燥、称量。
(3)编号2为MnO2作催化剂,氯酸钾分解制取氧气,化学方程式为:2KClO3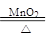 2KCl+3O2↑
2KCl+3O2↑
本题难度:一般
2、实验题 (16分)某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
组别
| 草酸的体积(mL)
| 温度/℃
| 其他物质
|
?
| 2 mL
| 20
|
|
?
| 2 mL
| 20
| 10滴饱和MnSO4溶液
|
?
| 2 mL
| 30
|
|
④
| 1 mL
| 20
| 1 mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化 学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
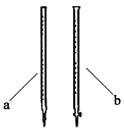
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
参考答案:Ⅰ.(1)①和② (2分);① 和 ③
(2
本题解析:
试题分析:Ⅰ.(1)如果研究催化剂对化学反应速率的影响需有对照实验,因此选①和②;如果研究温度对化学反应速率的影响需要其他因素相同做对照实验,因此选① 和 ③;(2)①和④中浓度不同, 确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变。Ⅱ.(1)由于KMnO4本身是紫红色,无需再加指示剂;(2)KMnO4盛装在酸式滴定管中;(3)
5C2O42-+2MnO4-+16H+= 10CO2↑+2Mn2++8H2O
5 2
x 1500×10-3 ×0.200
x =7.5 ×10-3 a(Na2C2O4)=7.5 ×10-3×134/1.34=75%
考点: 不同条件对化学反应速率影响酸碱中和滴定相关知识。
本题难度:一般
3、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由下图表示。在下列因素中:
①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度。影响反应速率的因素是
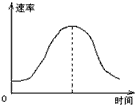
[???? ]
A.①④
B.③④
C.①②③
D.②③
参考答案:C
本题解析:
本题难度:一般
4、选择题 在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)  nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是 nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是
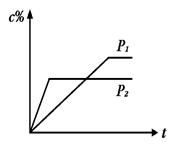
A.P1>P2,n<3
B.P1<P2,n>3
C.P1>P2,n>3
D.P1<P2,n<3
参考答案:B
本题解析:
试题分析:由图像可知P2条件下达平衡所用时间比P1达平衡所用时间短,可知P2>P1;压强增大,C的百分含量减小,平衡向逆反应方向移动,则n>3,答案选B。
考点:化学平衡
本题难度:一般
5、简答题 在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如下表,完成下列问题.
| t/℃ | 25 | 125 | 225 | …
K
4.1×105
K1
K2
…
(1)该反应的化学平衡常数表达式为K=______;K1______?K2(填“>”“<”或“=”);若增大压强使平衡向正反应方向移动,则平衡常数______(填“变”或“不变”).
(2)判断该反应达到化学平衡状态的依据是______(填序号):
A.2VH2(正)=3VNH3(逆)
B.N2的消耗速率等于H2的消耗速率
C.?溶器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min)
N2
H2
NH3
1
650
2
4
0.9
9
2
900
1
2
0.3
0.01
实验1中以v(NH3)表示的反应速率为______,实验2的速率比实验1快的原因是______;
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图).则其正极的电极反应为______.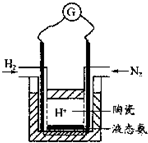
参考答案:(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+
本题解析:
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772