微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl 的浓度。影响反应速率的因素是?
的浓度。影响反应速率的因素是?
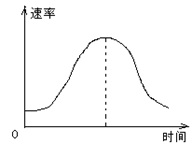 ?
?
A.①④
B.③④
C.①②③
D.②③
2、选择题 盐酸与碳酸钙固体反应时,下列措施能使最初的反应速率明显加快的是( )
A.增加碳酸钙的量
B.盐酸的用量增加一倍
C.盐酸的用量减半,浓度加倍
D.温度升高
3、填空题 (13分)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 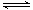 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 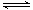 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 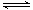 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D 增加CO的浓度 E 分离出二甲醚
(3)反应②2CH3OH(g)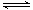 CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验
序号
| 温度
浓度
时间
| 0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.50
| 0.50
|
2
| 800℃
| c2
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800℃
| c3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
4、选择题 P(g)十Q(g) R(s),对此反应来说,下列能影响其反应速率的因素是:①温度②压强③生成物的浓度??? (??? )
R(s),对此反应来说,下列能影响其反应速率的因素是:①温度②压强③生成物的浓度??? (??? )
A.只有①
B.①和②
C.①和③
D.②和③
5、填空题 (11分)Ⅰ.下列各项分别与哪个影响化学反应速率因素的关系最为密切?
⑴夏天的食品易变霉,在冬天不易发生该现象_________???????????
⑵同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢?????????
⑶MnO2加入双氧水中放出气泡更快______________。
Ⅱ.在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
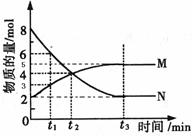
⑴比较t2时刻,正逆反应速率大小V正____ V逆。(填“>”、“=”、“<”)
⑵若t2 =2min,计算反应开始至t2时刻,M的平均化学反应速率为:________
⑶t3时刻化学反应达到平衡时反应物的转化率为_________
⑷如果升高温度则V逆____(填增大、减小或不变)