微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 重水(D2O)在25℃时,Kw=10-12 mol2·L-2,定义pD=-lg[c(D+)],pOD=-lg[c(OD-)], 则下列说法正确的是[???? ]
A.25℃时,纯重水中pD=7
B.25℃时,0.1 mol/L NaCl的重水溶液中pD=pOD=7
C.25℃时,1 mol/L的DCl重水溶液pD=0,pOD=12
D.25℃时,0.01 mol/L的NaOD溶液中pOD=10
参考答案:C
本题解析:
本题难度:一般
2、选择题 25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7.若x=
1
3
y,则x为( )
A.2
B.4
C.3
D.5
参考答案:反应后所得溶液pH=7,则酸中的H+的物质的量等于碱中OH-
本题解析:
本题难度:一般
3、简答题 某中学学生对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸?能够发生反应,设计并完成了如图1所示实验.X溶液是______,滴入的量一般为______.
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应.在盛有氢氧化钠溶液的试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量.
①写出测定溶液pH的方法:______.
②图2中哪个图象符合该同学的记录______(填序号).
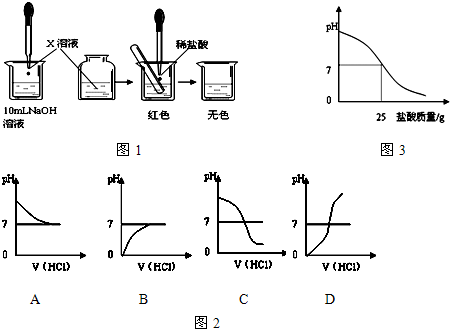
(3)你认为甲、乙两位同学的实验中,______(填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:______.
Ⅱ.丙同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置.实验时先在烧杯中加入20g?40%的氢氧化钠溶液,再逐滴加入该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系图(如图3).
(4)请以此次测定的结果,列式计算该盐酸的实际质量分数.
(5)请分析你的计算结果与标签标示的质量分数不一致的可能原因______.
参考答案:Ⅰ.(1)甲同学的做法是在滴有酚酞的NaOH溶液中滴加盐酸,
本题解析:
本题难度:一般
4、选择题 常温时,以下4种溶液pH最大的是[???? ]
A.0.01mol/L甲酸溶液
B.0.02mol/L甲酸溶液与0.02mol/L KOH溶液等体积混合后所得的溶液
C.0.03mol/L甲酸溶液与pH=12的NaOH溶液等体积混合后所得的溶液
D.甲酸溶液与NaOH溶液混合,得到c(HCOO-)= c(Na+)的溶液
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列各组溶液混合后,溶液一定呈中性的是( )
A.等体积、等物质的量浓度的氨水与盐酸混合
B.室温下pH之和为14的氨水与硝酸等体积混合
C.室温下pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合
D.等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合
参考答案:C
本题解析:
本题难度:简单
|