微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )
A.①NaCl②NaOH③NH3?H2O④H2SO4
B.①H2SO4②NaOH③NH3?H2O④NaCl
C.①H2SO4②NH3?H2O③NaOH④NaCl
D.①NaCl②NH3?H2O③NaOH④H2SO4

参考答案:从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的
本题解析:
本题难度:一般
2、实验题 根据下图所示一氧化碳还原铁的氧化物的实验装置,回答下列问题。

(1)怎样知道硬质玻璃管中Fe2O3已开始发生反应?
__________________________。
(2)在a处点燃,可观察到什么现象?为什么要点燃?________________________。?????
(3)实验结束时应注意的操作是________。
①先停止通入CO
②先熄灭酒精灯,并继续通入CO
③熄灭酒精灯,同时停止通入CO?
④先熄灭酒精灯,继续通入CO,并点燃排出的CO气体
参考答案:(1)当硬质玻璃管中红褐色物质开始变黑,b中澄清石灰水开始变
本题解析:
本题难度:一般
3、实验题 (共14分)某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
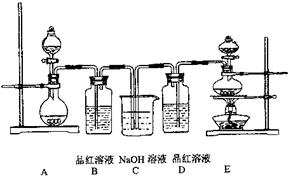
(1)实验室常用装置E制各Cl2,写出该反应的离子方程式__________________________指出该反应中浓盐酸所表现出的性质??????????
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B??????D?????????
(3)装置C的作用是???????????????????????
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
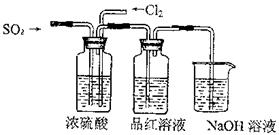
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:??????????????????。(用离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的???????????????????????
参考答案:(1)MnO2+4H++2Cl- 本题解析:
本题解析:
试题分析:(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应。该生成的无色物质不很稳定,受热又能分解放出SO2,而恢复原来的红色。氯气使品红褪色是氧化性漂白,不可还原,无法恢复。
点评:本题主要考查了二氧化硫的制备以及其相关性质的综合实验,解题过程中,应围绕课本基本知识,如“二氧化硫使品红溶液褪色”、“二氧化硫与氯气反应生成氯化氢和硫酸”等基础知识。同时,对于实验的设计,尤其是多因素影响的实验,应考虑“控制变量法”。
本题难度:一般
4、填空题 (12分)铁是人类使用最广泛的金属。
(1)一氧化碳在高温下可与氧化铁发生反应;

 2Fe+3CO
2Fe+3CO ,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol
,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol  ,则转移了_____mol电子,生成的CO
,则转移了_____mol电子,生成的CO 在标准状况下的体积是_________L。
在标准状况下的体积是_________L。
(2)下图是铁粉和水蒸气反应的实验装置示意图,写出该反应的化学方程式_______;实验中,D处排出的气体几乎点不着,已知该装置不漏气,使用的各种药品没有质量问题,你认为气体点不着的可能原因是(说出一点即可):_______________;改正的措施是:_________________。
参考答案:(12分)(每空2分)(1)Fe 本题解析:
本题解析:
试题分析:(1)根据方程式可知,铁元素的化合价从+3价降低到0价,得到3个电子,所以氧化铁是氧化剂。1mol氧化铁得到3mol×2=6mol电子。生成3molCO2,所以CO2的体积是67.2L。
(2)高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式是3Fe+4H O(g)
O(g) Fe
Fe O
O +4H
+4H 。装置不漏气,使用的各种药品没有质量问题,因此不能点着的原因可能是产生的氢气太少或水蒸气过多引起的。所以改进的措施是增加还原铁粉的用量或控制烧瓶加热温度,避免产生大量的水蒸气(或增加干燥剂用量)。
。装置不漏气,使用的各种药品没有质量问题,因此不能点着的原因可能是产生的氢气太少或水蒸气过多引起的。所以改进的措施是增加还原铁粉的用量或控制烧瓶加热温度,避免产生大量的水蒸气(或增加干燥剂用量)。
点评:该题是基础性试题的考查,试题基础性强,难易适中。该题中实验的考查主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
5、简答题 硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
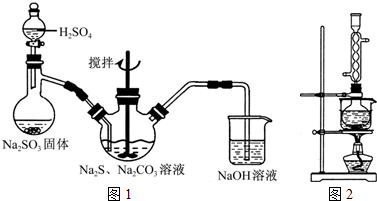
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是______.如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有______(填化学式)杂质生成.
(2)为测定所得保险粉样品中Na2S2O3?5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
①利用KIO3、KI和HCl可配制标准碘溶液.写出配制时所发生反应的离子方程式:______.
②准确称取一定质量的Na2S2O3?5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有______.
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3?5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”).
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待______时,停止加热,将烧瓶取下;
④______;
⑤______;
⑥将所得固体洗涤、干燥,得到Na2S?9H2O晶体.
参考答案:(1)装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫
本题解析:
本题难度:简单