微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② ? Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为????????,若有1mol Na2FeO2生成,则反应中有 ???mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 ????????????。
A.该生产过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是
??? ??。
2、填空题 交警常用“司机饮酒检测仪”检查司机是否酒后驾车,其原理是硫酸酸化的重铬酸盐(Cr2O72-橙红色)和乙醇反应生成铬盐(Cr3+绿色)和乙酸等。重铬酸钠(Na2Cr2O7)在工业中有很广泛的应用,常用来制备金属铬。方法如下:
将铬铁矿[主要成分Fe(CrO2)2]与纯碱、氧气高温焙烧,除杂、酸化,得到重铬酸钠,碳和重铬酸钠在高温下反应生成Cr2O3、Na2CO3和CO,Cr2O3再经铝热法还原,即可制得金属铬。请回答:
(1)硫酸酸化的K2Cr2O7和乙醇反应的化学方程式是?????????????????????。
(2)写出碳和重铬酸钠高温反应的化学方程式??????????????????????。
Cr2O3经铝热法还原制得金属铬的化学方程式是??????????????????。
(3)硫酸酸化的Na2Cr2O7和FeSO4反应,生成Cr3+等,该反应的离子方程式是?????????。
(4)某Na2Cr2O7样品2.00g恰好和4.56gFeSO4完全反应,该样品的纯度为???????????。
3、选择题 将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是(? )
A.原混合物中铜和铁各0.15 mol
B.稀硝酸的物质的量浓度为1 mol/L
C.第一次剩余的9.6 g金属为铜和铁
D.再加入上述200 mL稀硝酸,还能得到标准状况下2.24 L NO
4、选择题 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子物质的量之比为2∶1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象
5、选择题 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限。之所以有先后,主要取决于
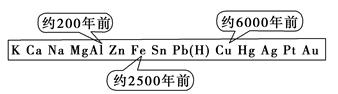
A.金属的化合价高低
B.金属的活动性大小
C.金属的导电性强弱
D.金属在地壳中的含量多少