微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下:
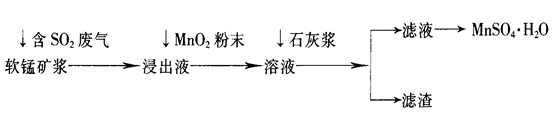
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 7.6
| 9.7
|
Fe3+
| 2.7
| 3.7
|
Al3+
| 3.8
| 4.7
|
Mn2+
| 8.3
| 9.8
?
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。
参考答案:(12分,每空2分)(1)SO2+MnO2=MnSO4?
本题解析:
试题分析:(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,这说明MnO2与SO2发生了氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4。
(2)杂质离子中Fe2+完全沉淀时的pH大于Mn2+开始沉淀时的pH,所以必须利用其还原性将其氧化成铁离子而除去。由于MnO2具有氧化性,能把亚铁离子氧化生成Fe3+,有关反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
(3)溶液的杂质离子Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,但不能超过8.3,以防止Mn2+也沉淀,所以只要调节pH值在4.7≤pH<8.3间即可。
(4)Fe3+、Al3+等金属阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时还生成微溶性的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,其化学式分别是Fe(OH)3、Al(OH)3、CaSO4。
本题难度:一般
2、实验题 (8分)用适当方法将下列混合物分离开来
(1)不溶性固体与水的混合物,如CaCO3与水,可用_______ 方法分离
(2)两种互相溶解但沸点相差较大的液体,如苯和四氯化碳的混合物,可用_______ 方法分离
(3)可溶性固体与水的混合物。如食盐和水,可用_______ 方法分离
(4)两种互不相溶的液体,如水和油,可用_______ 方法分离
参考答案:过滤,蒸馏,蒸发,分液
本题解析:萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法。
(1)碳酸钙不溶于水,过滤即可。
(2)两种互相溶解但沸点相差较大的液体,可用蒸馏的方法分离。
(3)可溶性固体与水的混合物的分离可用蒸发的方法分离。
(4)两种互不相溶的液体的分离,可用分液的方法分离。
本题难度:一般
3、选择题 为除去括号内的杂质,所选用的试剂或方法不正确的是[???? ]
A.Na2CO3溶液(NaHCO3),选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在空气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
参考答案:D
本题解析:
本题难度:一般
4、实验题 为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作:
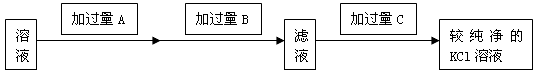
(1)写出三种试剂的化学式:A_________ ,B_____________ ,C_____________ 。
(2)加过量A的目的是:____________ , 有关反应的化学方程式为:___________ 、____________。
(3)加过量B的目的是:_________________ ,
(4)若先加过量C后再过滤,将对实验结果产生影响,其原因是_____________ 。
(5)将KCl溶液制成KCl晶体的蒸发操作过程中,要使用的主要仪器有:坩埚钳、铁架台(带铁圈)、玻璃棒、__________ 、____________ 。
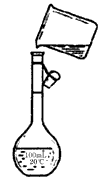
(6)用KCl晶体配制250 mL 0.2 mol/L KCl溶液时,下图是该同学转移溶液的示意图,图中的两处错误是: ① ______________;②_______________ 。
参考答案:(1)A: Ba(OH)2 ;B: K2CO3 ;C :HC
本题解析:
本题难度:一般
5、选择题 10.下列分离、提纯、鉴别物质的方法正确的是(??????)
A 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2杂质
参考答案:A
本题解析:胶体和溶液都能透过滤纸,应该用渗析法,B不正确。C不正确,两种物质均不溶于水。D不正确,直接加热除不去杂质,应该用沉淀法。所以正确的答案是。
本题难度:一般
|