微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,Na2CO3溶液中有平衡: 则下列说法正确的是(???)
则下列说法正确的是(???)
A.Na2CO3溶液中:c(Na+) > c(CO32-) > c(OH-) > c(H+)
B.加入NaOH固体,溶液pH减小
C.Na2CO3溶液中:c(Na+) +c(H+) =2c(CO32-) +c(OH-)
D.升高温度平衡向正反应方向移动
参考答案:AD
本题解析:
试题分析: Na2CO3溶液水解呈碱性,所以有c(Na+) > c(CO32-) > c(OH-) > c(H+),A正确;加入NaOH固体,c(OH-)增大,虽然使水解平衡左移,但是pH增大,所以B错误;Na2CO3溶液水解后生成了HCO3-,所以根据电荷守恒有c(Na+) +c(H+) =2c(CO32-) +c(OH-)+ c(HCO3-),所以C错误;水解反应是吸热的,所以升高温度,平衡正向移动,D正确;故选AD。
本题难度:一般
2、选择题 常温用水稀释0.1mol/l的醋酸钠溶液,溶液中增大的是(??? )
A.[H+]
B.[OH-]·[H+]
C.[OH-]
D.[H+]/[CH3COOH]
参考答案:AD
本题解析:在加水稀释时,CH3COONa的电离出CH3COO-水解程度增大,使n(CH3COO-)的总量减小,n(OH-)是增加的,但[OH-]和[CH3COO-]都是减小的,[CH3COO-]减小的更多,[H+]应是增大的,从而[H+]/[CH3COOH]也是增大的,[OH-]·[H+]是常数,不变的。
本题难度:一般
3、选择题 将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+) > c (X- ),则下列关系正确的是:
A.c (OH- ) < c (H+ )
B.c (HX ) < c (X- )
C.c (X- ) + c(HX )=" 2c" (Na+)
D.c (Na+ ) + c (HX) ="=" c( H+ ) +c (OH-)
参考答案:C
本题解析:由电荷守恒知c (Na+ ) +c( H+ )=c (X-) + c (OH-),若c(Na+) > c (X-),则c (OH-)> c (H+ ) ,A不正确。溶液显碱性,说明盐的水解程度大于酸的电离程度,因此c (HX )> c (X-) ,B不正确。由物料守恒可知c (X-) + c(HX )=2 c (Na+),选项C正确,将c (X-) + c(HX )=2c (Na+) 和c (Na+ ) +c( H+ )=c (X-) + c (OH-)合并得到c (Na+ ) + c (OH-)=
本题难度:简单
4、实验题 已知某溶液中只存在OH-、H+、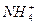 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(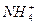 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(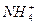 )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c(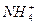 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(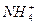 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为__________(填序号)。
(2)若四种离子的关系符合③,则溶质为__________;若四种离子的关系符合④,则溶质为__________ 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是__________(填图象符号)。
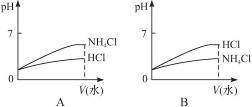
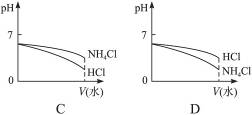
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
(5)如右图所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是___________,正极反应式是______________。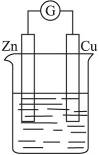
参考答案:(1)NH4Cl?①?(2)NH4Cl和NH3·H2ONH4
本题解析:(1)若溶液只有一种溶质,溶质为NH4Cl,因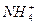 水解溶液显酸性,离子浓度的大小关系为c(Cl-)>c(
水解溶液显酸性,离子浓度的大小关系为c(Cl-)>c(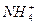 )>c(H+)
)>c(H+)
本题难度:简单
5、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是(???? )
A.用惰性电极电解饱和食盐水:2Cl-+ 2H+=H2↑+ Cl2↑
B.碱性氢氧燃料电池的正极反应式:O2+2H2O+4e-=4OH-
C.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
D.碳酸钠溶液呈碱性:CO32-+2H2O=H2CO3+2OH-
参考答案:B
本题解析:
试题分析:电解饱和食盐水,参与的是H2O,生成碱,故A错误;碱性氢氧燃料电池正极O2得电子生成OH-,B正确;钢铁发生电化学腐蚀,铁做负极,C错误;碳酸钠溶液呈碱性是由于二元弱酸根CO32-发生了两步水解,D错误;故选B。
本题难度:一般