微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中,属于电解质的是(???? )
A.氧气
B.铜
C.蔗糖(C12H22O11)
D.碳酸氢钠
参考答案:D
本题解析:电解质为在水溶液或熔融状态下能导电的化合物。AB单质既不是电解质也不是非电解质;C为非电解质;答案为D。
本题难度:一般
2、选择题 下列各溶液中,有关成分的物质的量浓度关系正确的是 (??)
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4、 (NH4)2Fe (SO4)2、NH4Cl溶液:c(NH4Cl)<c[(NH4)2Fe (SO4)2]< c[(NH4)2SO4]
参考答案:C
本题解析:
试题分析:10mL0.5mol·L-1CH3COONa溶液与6mLlmol·L-1盐酸混合,发生反应,相对于溶液中CH3COOH、NaCl、HCl的物质的量浓度之比为5:5:1,所以c(Cl-)>c(Na+),溶液呈酸性,c(H+)>c(OH-),醋酸是弱酸,发生电离,电离程度不大,所以c(Na+)>c(CH3COO-),c(H+)>c(CH3COO-),故为c(Cl-)>c(Na+)>c(H+)>c(CH3COO-)>c(OH-),故A错误;0.1mol·L-1的NaHB溶液pH为4,说明HB-
本题难度:一般
3、选择题 下列有关电解质溶液中微粒浓度关系不正确的是
A.0.lmol/LpH=4的NaHA溶液中: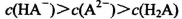
B.1mol/L的NaHCO3溶液中: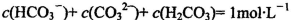
C.常温下,pH=7的NH4Cl与氨水的混合溶液中:
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中:
参考答案:D
本题解析:
试题分析:A.0.lmol/L的NaHA溶液,pH=4,则C(H+)=10-3mol/L<0.lmol/L.说明H2A为弱酸,NaHA是强酸弱碱盐,由于pH=4,,说明HA-的电离大于水解,所以C(H+)>C(OH-),C(A2-) > C(H2A)。但是弱酸根离子的水解或或电离作用是很微弱的。故这几种离子的浓度大小关系是:C(HA-)> C(A2-) > C(H2A)。正确。B.1mol/L的NaHCO3溶液中:根据物料守恒可知:C(Na+)=C(HCO3-)(始)
本题难度:一般
4、选择题 用物质的量均是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是(???)
A.c(CH3COOH)>c(CH3COO-)
B.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
C.c(H+)>c(OH-)
D.c(CH3COO-)+c(OH-)=0.1 mol·L-1
参考答案:C
本题解析:c(CH3COO-)大于c(Na+),所以根据电荷守恒定律可知,溶液显酸性。这说明醋酸的电离程度大于醋酸钠的水解程度,因此C正确,A不正确,应该是c(CH3COOH)<c(CH3COO-) ;B不正确,应该是c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1;D不正确,应该是c(CH3COO-)+c(OH-)>0.1 mol·L-1,所以答案选C。
本题难度:一般
5、选择题 向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是??????
A.当V=0时,c(OH-)=c(H+)+c(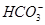 )+c(H2CO3)
)+c(H2CO3)
B.当V=5时,c(Na+)+c(H+)=2c(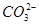 )+c(
)+c(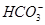 )+c(OH-)
)+c(OH-)
C.当V=10时,c(Cl-)=c(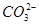 )+c(
)+c(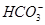 )+c(H2CO3)
)+c(H2CO3)
D.当V=15时,c(Na+)=c(Cl-)>c(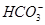 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
参考答案:C
本题解析:在碳酸钠溶液中存在碳酸钠的水解和水的电离,由质子守恒可得:c(OH-)=c(H+)+c(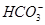 )+2c(H2CO3),A错误;当V=5时溶液中的溶质是碳酸钠、碳酸氢钠和氯化钠,由物质电中性原则可得:c(H+)+c(Na+
)+2c(H2CO3),A错误;当V=5时溶液中的溶质是碳酸钠、碳酸氢钠和氯化钠,由物质电中性原则可得:c(H+)+c(Na+
本题难度:一般