微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 括号内物质为杂质,下列除去杂质的做法不正确的是
A.乙酸乙酯(乙酸和乙醇):用饱和Na2CO3溶液洗涤后分液
B.乙烷(乙烯):用浓溴水洗气
C.乙醇(乙酸):用NaOH溶液中和后分液
D.乙醇(水):用生石灰吸水后蒸馏
参考答案:C
本题解析:略
本题难度:简单
2、填空题 三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒人蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
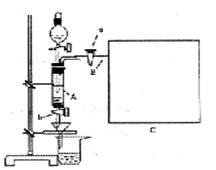
填写下列空白:
(1)如何检查装置A的气密性:???????????????????。
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与铁粉反应要快,其原因是?????????。
(3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由???????????????????。
(4)用该法制得的晶体中往往混有Fe(NO3)3,为了制得较纯净的FeCl3·6H2O,可将烧杯内的稀硝酸换成?????????。
(5)若要测废铁屑的纯度,可测出从B处放出气体的体积,测量气体体积时,需待气体冷却至室温时进行,现有下列装置测定从B处放出气体的体积(忽略导管在量筒中所占的体积),应选用?????????(填序号),理由是?????????。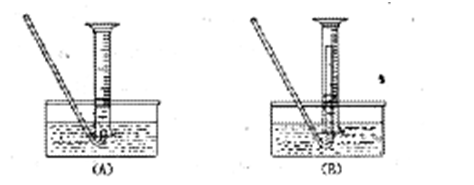
参考答案:(1)关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,
本题解析:
(1)检查气密性的操作,注意要叙述完整:关闭活塞a、活塞b,打开分液漏斗活塞和瓶盖,从中注水,漏斗下端会形成一段液柱,一段时间后,若液柱缓缓下移,说明气密性不好,若液柱停止不动,则说明气密性好。(或关闭分液漏斗活塞和活塞b,打开活塞a,将管口B接一段带玻璃管的乳胶管井引入水槽中,用双手捂住装置A,若水槽中有气泡产生,放开双手玻璃管中形成一段液柱,则气密性良好。)
⑵原电池能加快某些氧化还原反应速率,所以:铁粉与杂质铜形成原电池反应,加快了反应速率。
⑶用直接蒸发,最后得到以Fe2O3为主的混合物,不用用直接蒸发的理由是:因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O晶体;
⑷双氧水或新制氯水等氧化剂,前者还原产物是水,后者生成氯化物;
⑸①B;防止气体冷却时发生倒吸现象。
本题难度:一般
3、选择题 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )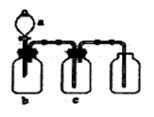

参考答案:D
本题解析:
试题分析:A中的NO2能被氢氧化钠溶液吸收,所以选项A不正确;B中的反应需要加热,且SO2能被酸性高锰酸钾溶液氧化,B不正确;C中氨气的密度小于空气的,应该用向下排空气法收集,C不正确,因此正确的答案选D。
点评:该题主要是考查学生对常见气体制备原理以及收集方法的了解程度,属于基础性试题的检验,难度不大。该题的关键是记住气体的制备原理和气体的性质,然后结合题意灵活运用即可。
本题难度:一般
4、实验题 化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:_________________
_______________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
参考答案:⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解
本题解析:本题涉及的制备是我们不熟悉的物质的制备,因此关于制备细节的考察,要么可以由我们以前的知识迁移而来,要么在题干中有所提示。
(1)故“冰水冷却”这句话很容易使我们想到是为了抑制溶解平衡,析出更多的晶体(这是知识的迁移);而“在黑暗处等待晶体析出”则和题干中的“光敏材料”对应,当推知黑暗是为了防止晶体见光分解。
(2)这是原有知识在新情境下的应用,考虑到前一步是结晶,结晶后自然要将晶体与母液分离、所以需要“过滤”, 如果再加上“洗涤”就更加严密。
(3)仍然是原有知识在具体新情境下的应用,题目中明确说道包含物质的量溶液配制和滴定实验,所以需要容量瓶和滴定管。关键是要准确写出“100mL容量瓶”,而KMnO4溶液有强氧化性,需用酸式滴定管盛放。关于终点颜色的判断,需要同学准确理解该滴定实验的原理,该实验是氧化还原滴定,终点时KMnO4溶液恰好过量一滴,故溶液会显紫红色。
(4)由题意求得:n(Fe3+)=0.001mol,n(C2O42-)=0.003mol,代入化学式,可求得x=3。
本题难度:一般
5、实验题 (13分)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)。

试回答:
(1)上述实验中生成二氧化硫的反应的化学方程式为:??????????????????????????
(2)乙同学认为还可能产生氢气的理由:????????????????????????????????????
????????????????????????????????????????????????????????????。
(3)丙同学在安装好装置后,必不可少的一步操作是:????????????????????????。
(4)A中加入的试剂可能是____________,作用是_???????????????????????????;
B中加入的试剂可能是____________,作用是????????????????????????????;
E中加入的试剂可能是____________,作用是????????????????????????????。
(5)可以证明气体X中含有氢气的实验现象是:
C中:????????????????????????????,D中:??????????????????????????;
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____________
(填“能”或“不能”);其原因是:?????????????????????????????????????。
参考答案:(13分)(每空1分)
(1) 本题解析:略
本题解析:略
本题难度:简单