微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用酸性氢氧燃料电池电解苦卤水(含Cl—、Br—、Na+、Mg2+)的装置如下图所示(a、b为石墨电极),下列说法正确的是
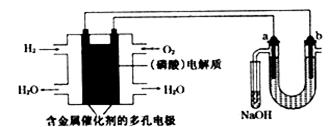
A.电池工作时,正极反应式为O2+2H2O+4e-=4OH-
B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
C.试管中NaOH溶液是用来吸收电解时产生的Cl2
D.当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.02mol气体
参考答案:D
本题解析:
试题分析:A.电池的正极是氧气得到电子,电极反应为:O2+4e—+4H+=2H2O或O2+4e—+3H3PO4=H2PO4—+H2O;错误;B.电子只能在外电路中流动不能通过电解质溶液,电解质溶液是靠离子迁移来传递电荷,错误;C. 溶液中阴离子的放电顺序是:Br->Cl->OH-,电解池中阳极装NaOH溶液的试管主要是用来吸收产生的溴蒸气,也吸收可能产生的Cl2,错误;D. n(H2)=2.24L÷22.4L/mol=0.1mol,当电池中消耗0.1 mol H2时,转移0.2mol的电子,则在电解池的阴极也会产生0.1 molH2。正确。
考点:考查原电池和电解原理的应用的知识。
本题难度:困难
2、选择题 用质量均为100 g的铜片作电极,电解AgNO3溶液,电解一段时间后两极质量相差28 g,此时阳极质量为
A.121.6 g
B.93.6 g
C.89.6 g
D.88.2 g
参考答案:B
本题解析:
本题难度:简单
3、填空题 科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为______________________。要清洗附着在试管壁上的硫,可用的试剂是______________________。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320°C左右,电池反应为2Na+xS = NaSx,正极的电极反应式为________________________。M(由NaO和AlO制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
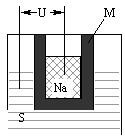
(3)Na2S溶液中离子浓度由大到小的顺序为__________________,向该溶液中加入少量固体CuSO4溶液pH________(填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为___________________________________(用离子方程式表示)。
参考答案:(1)2CH3CH2OH+2Na ![]() 本题解析:
本题解析:
本题难度:一般
4、选择题 某同学根据原电池原理设计了“苹果电池”(如图),下列有关说法中正确的是( )
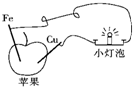
A.苹果里有电解质溶液
B.铁片是此“苹果电池”的正极
C.将苹果换成番茄,小灯泡就不亮了
D.一段时间后取出Cu片,其质量减少
参考答案:A、两个电极插入苹果,灯泡发亮,说明形成了原电池反应,苹果中
本题解析:
本题难度:简单
5、计算题 研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
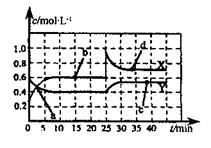
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
(3)25℃时,将NH3溶于水得100 mL0.1 mol ? L-1的氨水,测得pH=11,则该条件下,NH3 ? H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g)?△H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g)?△H=-112kJ/mol;
2C(s)+O2(g)=2CO(g)?△H=-221kJ/mol;
C(s)+O2(g)=CO2 (g)?△H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。
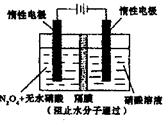
参考答案:(每空2分,共14分)(1)NO和NO2??(2)Y;
本题解析:
试题分析:(1)根据反应的方程式可知,氨气中氮元素的化合价从-3价升高到0价,失去3个电子,因此氨气是还原剂。NO和NO2中氮元素的化合价分别从+2价和+4价降低0价,得到2个和4个电子,因此氧化剂是NO和NO2。
(2)由图可知10~25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6=0.4)mol/L=0.2mol/L。即X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随
本题难度:困难