微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知0.1mol X2O72- 能将100mL,3mol/L SO32-氧化成SO42-,则X元素被还原后的化合价是
A.0
B.+2
C.+3
D.+4
参考答案:C
本题解析:
试题分析:亚硫酸根离子中的硫元素化合价从+4升高到+6,总共失去的电子物质的量为2×0.1×3=0.6摩尔,等于X元素得到的电子的物质的量,故X变化的化合价为0.6÷0.1÷2=3,原来X的化合价为+6,故被还原后的化合价为+6-3=+3,故选C。
考点:氧化还原反应中电子守恒。
本题难度:一般
2、选择题 对于Cl2+SO2+2H2O =H2SO4+2HCl反应,下列说法正确的是
①Cl2是氧化剂 ??②SO2被氧化 ?③Cl2被氧化 ④Cl2发生还原反应
⑤SO2具有还原性 ⑥Cl2具有氧化性
A.只有①②⑥
B.只有②③④
C.只有②④⑤⑥
D.只有①②④⑤⑥
参考答案:D
本题解析:
试题分析:反应中氯气为氧化剂具有氧化性,反应中被还原,发生还原反应;二氧化硫为还原剂具有还原性,反应中被氧化,发生氧化反应;故D正确。
本题难度:一般
3、填空题 (14分)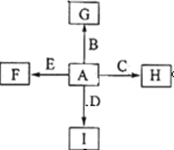
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
① 反应C+G B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
参考答案:⑴2Al+Fe2O3 本题解析:
本题解析:
试题分析:根据题意及物质之间的转化关系可知:A是O2;B是Fe;C是Al;D是C;E是Mg;F是MgO;G是Fe2O3;H是Al2O3;I是CO2;(1) ①中是Al与Fe2O3发生的铝热反应,反应的化学方程式为2Al+Fe2O3 2Fe+Al2O3;(2) G是Fe2O3,1.6g G 的物质的量是1.6g÷160g/mol=0.01mol,溶于盐酸,得到FeCl3溶液与铜粉反应,2FeCl3+Cu= 2FeCl2+ CuCl2,根据Fe守恒可得:n(FeCl3)=0.02mol,则根据方程式可知:其完全反应需要消耗Cu的物质的量是0.01mol,其质量是0.01mol×64g/mol=0.64g。(3) Al与过量NaOH溶液反应的离子方程式为2Al+2OH- + 2H2O==2AlO2-+3H2↑;反应后的溶液是NaAlO2,与过量的化合物I反应的离子方程式为AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(5) Al2O3是离子化合物,熔沸点高,可以作耐火材料,也可以用于电解冶炼铝。(6)将一定量的Fe完全溶于过量盐酸中得到FeCl2溶液,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。在氧化还原反应中电子得失数目相等,所以n(Fe2+)×1=n(Cl2)×2+n(K2Cr2O7)×2×3. n(Fe2+)=0.005mol×2+0.01mol×2×3=0.07mol.根据Fe守恒可知n(Fe)= n(Fe2+)=0.07mol,故选项是D。
2Fe+Al2O3;(2) G是Fe2O3,1.6g G 的物质的量是1.6g÷160g/mol=0.01mol,溶于盐酸,得到FeCl3溶液与铜粉反应,2FeCl3+Cu= 2FeCl2+ CuCl2,根据Fe守恒可得:n(FeCl3)=0.02mol,则根据方程式可知:其完全反应需要消耗Cu的物质的量是0.01mol,其质量是0.01mol×64g/mol=0.64g。(3) Al与过量NaOH溶液反应的离子方程式为2Al+2OH- + 2H2O==2AlO2-+3H2↑;反应后的溶液是NaAlO2,与过量的化合物I反应的离子方程式为AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(5) Al2O3是离子化合物,熔沸点高,可以作耐火材料,也可以用于电解冶炼铝。(6)将一定量的Fe完全溶于过量盐酸中得到FeCl2溶液,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。在氧化还原反应中电子得失数目相等,所以n(Fe2+)×1=n(Cl2)×2+n(K2Cr2O7)×2×3. n(Fe2+)=0.005mol×2+0.01mol×2×3=0.07mol.根据Fe守恒可知n(Fe)= n(Fe2+)=0.07mol,故选项是D。
考点:考查元素及化合物的知识,只有包括物质的推断、性质、用途、化学方程式的书写、守恒法的应用。
本题难度:一般
4、推断题 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
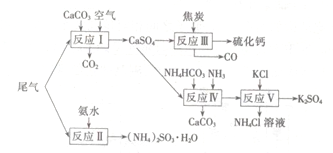
(1)反应III中氧化剂与还原剂的物质的量之比为 。
(2)反应Ⅳ的化学方程式为 。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为 。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下:

(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____ 的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为 。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为 。
参考答案:(1)1
本题解析:
本题难度:一般
5、选择题 下列物质分别与水发生反应:①Na、②NaH、③NO2、④Cl2、⑤SO3、
⑥Na2O2,其中属于氧化还原反应,但水既不是氧化剂又不是还原剂的是( )
A.①③⑥
B.②⑤
C.③④⑥
D.④⑤⑥
参考答案:C
本题解析:NaH+H2O=NaOH+H2↑,Na、NaH与水反应时,水是氧化剂;NO2、Cl2、Na2O2与水的反应是歧化反应;SO3与水的反应是非氧化还原反应。
本题难度:一般