微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是[???? ]
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.1个KClO3参加反应有2个电子转移
D.H2C2O4在反应中被氧化
参考答案:D
本题解析:
解析:
选项A、因反应中Cl元素的化合价由+5降低为+4价,则KClO3在反应中得到电子,故A错误;
选项B、Cl元素的化合价降低,被还原,对应的产物为还原产物,即ClO2是还原产物,故B错误;
选项C、Cl元素的化合价由+5降低为+4价,1molKClO3参加反应转移的电子为1mol×(5-4)=1mol,故C
本题难度:简单
2、推断题 (12分)按图所示实验过程填空:
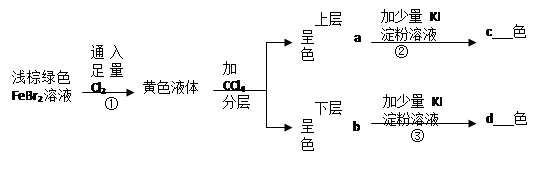
(1)写出上述反应的离子方程式:
①???????????????????????②???????????????????????③???????????????????
(2)填空:
a???????????b ?????????????c?????????????d?????????????
参考答案:(1)① 2Fe2++4Br-+3Cl2=2Fe3++6Cl
本题解析:
试题分析:①发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2,所得的黄色液体为溴水。加CCl4后分层,上层为FeCl3溶液,呈棕黄色;下层为溴的CCl4溶液,呈橙红色;②发生的反应为:2Fe3++2I-=2Fe2++I2,反应后所得的溶液的溶质为I2,I2遇淀粉变蓝色。③发生的反应为:Br2+2I-=2Br-+I2,淀粉遇碘变蓝色。
点评:此题考查卤素单质之间的相互转换,属于基础题。对于卤素单质,应特别注意其颜色。
本题难度:一般
3、选择题 下列关于氧化还原反应的说法正确是
A.水在化学反应中既可以作氧化剂,又可以作还原剂
B.1molCl2与足量Fe反应,转移的电子数为3NA
C.发生化学反应时失去电子数越多的金属原子,还原能力越强
D.若A2+2D- =2A-+D2,则氧化性:D2>A2
参考答案:A
本题解析:
试题分析:A、水中氢元素的化合价最高,只能得到电子。氧元素的化合价最低,只能失去电子,所以水在化学反应中既可以作氧化剂,又可以作还原剂,A正确;B、氯气与铁反应得到2个电子,所以1molCl2与足量Fe反应,转移的电子数为2NA,B不正确;金属性强弱与金属原子失去电子的多少无关,只与金属失去电子的难易程度有关。越易失去电子,金属性越强,C不正确;D、在氧化还原反应中氧化剂的氧化性强于氧化产物,则根据反应A2+2D- =2A-+D2可知,氧化剂是A2,氧化产物是D2,则氧化性:A2>D2,D不正确,
本题难度:一般
4、选择题 Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是???????
A.2
B.3
C.4
D.5
参考答案:D
本题解析:
试题分析:因为在NaClO中Cl的化合价为+1,价,反应后被还原为NaCl,化合价为-1,每1mol的Cl得到2mol的电子,则电子转移的物质的量为32mol,,S的化合价在反应前为-2/x,反应后为+6价,每1mol的S化合价升高数值为(6+2/x,则xmol的S化合价升高6x+2价,由于在氧化还原和反应化合价升降总数相等,所以6x+2=32,解得x=5。选项为D。
本题难度:一般
5、选择题 对于反应3Cl2+6NaOH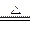 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1
C.Cl2既作氧化剂又作还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
参考答案:C
本题解析:分析化合价可知,氯气既是氧化剂又是还原剂,被氧化的Cl原子和被还原的Cl原子的物质的量的比为1∶5,氧化剂得电子数与还原剂失电子数总数应相等。
本题难度:简单