微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 电解硫酸溶液时,放出25mL(标况)O2,若以等量的电量在同样条件下电解盐酸溶液,所放出的气体的体积最接近下列数据中的( )
A.45mL
B.50mL
C.75mL
D.100mL
参考答案:电解硫酸实质上为水的电解,阳极反应为4OH--4e-=H2O
本题解析:
本题难度:一般
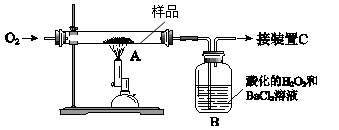
2、实验题 21.(10分)某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测定其铁、硫元素的质量分数。
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器。取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2。
① 装置B中的H2O2反应时表现出了 性。
② 欲计算硫元素的质量分数,需测量的数据是 。
③ 传感器的工作原理如下图所示。

传感器中阴极的电极反应式是 。
(2)为测来源:91考试网定铁元素的质量分数,继续实验。
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液。
① a中滤液含有的金属阳离子是 。
② b中反应的离子方程式是 。
③ c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是 。
参考答案:(1)① 氧化性 ② B中沉淀的质量
③ 2
本题解析:
试题分析:(1)①取中药样品于装置A中,经充分反应,硫元素全部转化为SO2和SO3,将物质转移入酸化的H2O2和氯化钡溶液中,产生了白色沉淀,该白色沉淀为硫酸钡,在这个过程中H2O2将+4价的S全部氧化为+6价的S,最终全部变为硫酸钡,故H2O2表现的是氧化性;②要计算硫元素的质量分数,需测量B中产生的白色沉淀硫酸钡的质量,根据质量确定硫元素的质量分数;③ 根据传感器的工作原理可知阴极电解质溶液得电子,HSO3-得电子后转变为S2O42-,电极方程式为2HSO3-+2H++2e-= S2O42-+2H2O;(2)a项将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液,说明溶液中除了存在Fe2+外,还存在着Fe3+;b项向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+,离子方程式为FeCl3 + TiCl3+H2O= FeCl2+TiO Cl2+2H Cl,离子方程式为Fe3+ + Ti3+ +H2O= Fe2++TiO2+ +2H+;c项用滴定法测定Fe2+的量,K2Cr2O7被还原为Cr3+,发生的化学反应方程式为:6FeSO4+K2Cr2O7+7H2SO4=3Fe2(SO4)3+K2SO4+Cr2(SO4)3+7H2O,离子方程式为6Fe2+ + Cr2O72- +14H+ =6Fe3+ +2Cr3+ +7H2O,消耗v mL n mol/LK2Cr2O7溶液则有n(Cr2O72-)=nv×10-3mol,根据方程式计算可得n(Fe)=nv×10-3×6mol,那么m(Fe)= nv×10-3×6×56g/mol="0.336" nvg,则铁元素质量分数的数学表示式为ω= =
=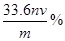
考点:元素性质及基本计算
点评:本题主要考察了元素及其化合物的相关性质和计算,考察内容较多,涉及了化学反应方程式的书写以及二价铁的滴定,本题的关键是确定二价铁和三价铁之间的相互转化。
本题难度:困难
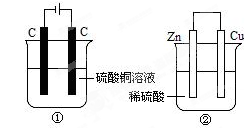
3、选择题 下图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5 mol·L-1,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是?
 ?
?
A.产生气体体积 ①<②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑ ②中负极:2H++2e-=H2↑
D.溶液的pH变化:①减小,②增大
参考答案:AD
本题解析:
分析:根据电池的工作原理写出电极反应,在两极上,得失电子数相等,可以根据电子守恒来进行相关的计算.
解:A、①是电解池,电极反应为:阳极:4OH-→O2↑+2H2O+4e-,阴极:Cu2++2e-→Cu,②是原电池,正极反应:2H++2e-→H2,负极反应:Zn+2e-→Zn2+,液体体积均为200mL,浓度均为0.5mol/L,所以硫酸铜、硫酸的物质的量均为0.1mol,当有0.02mol的电子通过时,①产生的气体是氧气,为0.005mol,②中0.01mol氢气放出,所以①<¬②,故A正
本题难度:简单
4、选择题 将含有0.4molCu(NO3)2和0.4molKCl的水溶液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另?一个电极上放出气体的体积(标准状况)约为(????)。
A.5 .6L
B.6.72L
C.2.8L
D.13.44L
参考答案:A
本题解析:
试题分析:在阴极析出0.3molCu,则电路中转移了0.6mol电子。阳极有0.4molCl-失电子,失去0.4mol电子,产生0.2molCl2,另外还有0.2mol电子是OH-失去的,产生0.05molO2,因此一共产生标准状况下的气体5.6L,A正确。
点评:考查电解池的原理,具有一定的难度,侧重考查学生的逻辑推理能力和分析问题的能力,解题的关键是找出电极反应得失电子的情况,从而准确解答。
本题难度:简单
5、填空题 按下图装置进行实验,并回答下列问题

(1)判断装置的名称:A池为___________ B池为______________
(2)锌极为__________极,电极反应式为_______________________
(3)石墨棒C1为______极,电极反应式为_______________________ 石墨棒C2附近发生的实验现象为
____________________________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。
参考答案:(1)原电池;电解池
(2)负;Zn-2e-==Zn
本题解析:
本题难度:一般