微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列两种气体的分子数一定相等的是
A.质量相等、密度不同的N2和C2H4
B.体积相等的CO和N2
C.等温、等体积的O2和N2
D.等压、等体积的N2和CH4
参考答案:A
本题解析:N2和C2H4这两种气体的摩尔质量相等,质量相等时,物质的量也就相等,所含的分子数也一定相等,A项正确。B、C、D项可根据阿伏加德罗定律及其推论加以判断,所含分子数均不一定相等。答案选A。
本题难度:一般
2、选择题 化学反应aM+bN====cW+dE,已知20 g M和10.5 g N恰好完全反应,生成16.5 g E,则M与W的摩尔质量比为( )
参考答案:C
本题解析:根据质量守恒:
aM+bN====cW+dE
20 g 10.5 g 14 g 16.5 g
即M与W的摩尔质量比为: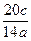 =10c∶7a。
=10c∶7a。
A.10a∶7c B.7a∶10c C.10c∶7a D.7c∶10a
本题难度:一般
3、选择题 用已准确称量过的氯化钠固体配成100ml1mol/l的氯化钠溶液,需要用到下列仪器中的( )
①坩埚②分液漏斗③100ml容量瓶④烧瓶⑤胶头滴管⑥烧杯⑦玻璃棒⑧托盘天平.
A.③④⑤⑧
B.①②④⑧
C.③⑤⑥⑦
D.①③⑥⑦
参考答案:称量完氯化钠后,需要使用烧杯和玻璃棒溶解氯化钠,然后将溶解的
本题解析:
本题难度:简单
4、选择题 把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A.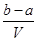 mol·L-1
mol·L-1
B.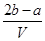 mol·L-1
mol·L-1
C. mol·L-1
mol·L-1
D.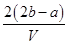 mol·L-1
mol·L-1
参考答案:D
本题解析:
试题分析:此题解题技巧为利用电荷守恒法计算。首先分析混合溶液中,有带正电的Mg2+和K+,带负电的只有SO42-。已知分成两等份,一份加入a mol NaOH,可知此份中含有Mg2+的物质的量为0.5amol,另一份加入b mol BaCl2,可知此份中SO42-的物质的量为b mol,再由正、负电荷代数和为零得:0.5a×2+n(K+)×1==b×2,所以每一份中n(K+)==(2b-a)mol,所以每一份中也就是原溶液中C(K+)= n(K+)/0.5V==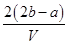 ,D正确。
,D正确。
考点:考查溶液中离子物质的量浓度计算。
点评:注意平时训练守恒思想在化学计算题中应用,简洁清晰的解出正确答案。
本题难度:一般
5、填空题 (8分)在标准状况下,(a)4 g H2 (b)11.2 L O2 (c)27mL H2O中,所含分子数最多的是(填序号)①_________,含原子数最多的是② ,体积最大的是③ ,质量由大到小的顺序是④ 。
参考答案:a, c, a, c、b
本题解析:4g氢气的物质的量是4g÷2g/mol=2mol,含有的原子是4mol;标准状况下,11.2LCO2的物质的量是11.2L÷22.4L/mol=0.5mol,,质量是22g,含有的原子是1.5mol;27ml水的质量是27g,物质的量是27g÷18g/mol=1.5mol,含有的原子是4.5mol。所以分子数最多的是a;原子数最多的是c;体积最大的是a;质量由大到小的顺序是c、b、a。
本题难度:一般