微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
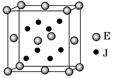
1、填空题 已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大。A与另外四种元素既不在同一周期,也不在同一主族。J和D同主族,E和G同周期;元素G是周期表中的第7列元素,E的最外层电子数与最内层电子数相同,E跟J可形成离子化合物,其晶胞结构(其中J原子在晶胞内部)如图。
请回答下列问题:
(1)D元素-1价离子的电子排布式为???????????????????????;G元素原子的价电子排布式为???????????????????????????。
(2)元素J与氮元素可以形成化合物NJ3,其中N—J键的化学键类型为???????,根据价层电子对互斥理论可以判断NJ3的空间构型为???????,NJ3分子中N原子的杂化方式为???????杂化。
(3)A、J形成的化合物AJ的相对分子质量比A、D形成的化合物AD的相对分子质量小,但AJ的沸点比AD高,其原因是?????????????????????????。
(4)从晶胞图可以得出:E与J形成的离子化合物的化学式为??????????????。
(5)含有E元素的化合物焰色反应为?????色,焰色反应的原理是??????????。
参考答案:(1)1s22s22p63s23p6(2分) ? 3d54s
本题解析:
试题分析: A与另外四种元素既不在同一周期,也不在同一主族。判断A是H元素;元素G是周期表中的第7列元素,则G是周期表中第四周期第七副族元素Mn元素;E和G同周期,E的最外层电子数与最内层电子数相同,最内层电子数是2,所以E是Ca元素;E跟J可形成离子化合物,通过计算其晶胞结构中E与J的离子个数比是1:2,则J是-1价非金属;J和D同主族,所以J和D应为F、Cl元素。
(1)Cl元素-1价离子的电子排布式为1s22s22p63s23p6,G是25号Mn元素,其价电子排布式为3d54s2
本题难度:一般
2、填空题 (14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期
|
C原子核外所有p轨道全满或半满
|
D元素的主族序数与周期数的差为4
|
E是前四周期中电负性最小的元素
|
F在周期表的第七列
(1)A基态原子中能量最高的电子,其电子云在空间有????????个方向,原子轨道呈???????形。
(2)某同学根据上述信息,所画的B电子排布图如图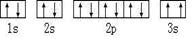 ,违背了??原理。 ,违背了??原理。
(3)F位于??????????族??????区,其基态原子有?????种运动状态。
(4)CD3 中心原子的杂化方式为?????,用价层电子对互斥理论推测其分子空间构型为????????,检验E元素的方法是???????????????。
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为???????,该单质晶体中原子的堆积方式为四种基本堆积方式中的??????。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
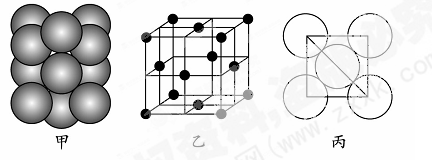
参考答案:(1)3;纺锤形或哑铃形?(2)泡利不相容?(3)第三周期第
本题解析:
试题分析:A、B、C、D、E为短周期主族元素,原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子核外所有p轨道全满或半满,结合原子序数可知,价电子为3s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F在周期表的第七列
本题难度:一般
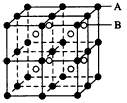
3、填空题 (1)由A、B两元素组成的离子晶体结构(甲)如图所示,则该晶体的化学式是:___________。
(2)C原子的最外层电子排布为nsnnpm,其某一激发态可使这两个亚层的每一个轨道都处于全满状态,1个C原子与2个D原子结合,使双方都达到8电子稳定结构。则在C与D形成的分子中,C原子发生轨道的杂化方式是________,分子构型是________,从成键方式看,该分子中含有的共价键的类型和数目分别是________________
(3)C与D形成的常见晶体(乙),与甲晶体的熔点相比,乙____甲,其原因是___________________。
参考答案:(1)AB或BA
(2)sp;直线形;2个σ键、2个
本题解析:
本题难度:一般
4、选择题 科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有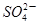 和 和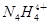 两种离子,当 两种离子,当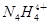 遇到碱性溶液时,会生成N4分子。下列说法正确的是 遇到碱性溶液时,会生成N4分子。下列说法正确的是
A.14N、N4与N2互为同位素
B.N4H4(SO4)2的电离方程式为N4H4(SO4)2 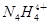 +2 +2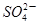
C.N4H4(SO4)2不能与草木灰、K3PO4等化肥混合施用
D.N4H4(SO4)2中只含有共价键,不含离子键
参考答案:C
本题解析:
试题分析:A、同种元素的不同原子之间互称为同位素,N4与N2为单质,错误;B、N4H4(SO4)2晶体中含有SO42-和N4H44+两种离子,N4H4(SO4)2为离子化合物,电离方程式为:N4H4(SO4)2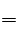 N4H44++2SO42-,错误;C、草木灰、K3PO4都为强碱弱酸盐,其水溶液显碱性,当N4 N4H44++2SO42-,错误;C、草木灰、K3PO4都为强碱弱酸盐,其水溶液显碱性,当N4
本题难度:一般
5、填空题 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子核外电子排布图为______________________________;
(2)写出与H2O分子互为等电子体的微粒______________________(填2种);
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________;
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(4)在冰晶体中,以一个水分子为中心,画出水分子间最基本的连接方式(水分子用结构式表示);
(5)下列是钾、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____,D晶体的空间利用率为??????。
参考答案:(1) 本题解析: 本题解析:
试题分析::Ⅰ.(2)H2O分子中的原子数为3,价电子数为10,H2S、NH2-的原子数目均为3,价电子数目均为10,则与水互为等电子体,故答案为:H2S、NH2-;
(3)A、水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A不合理;
B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B合理;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,故C合理;
D、水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D合
本题难度:一般
|