微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
A.加入适量的氢氧化钠固体
B.将溶液稀释到原体积的 10倍
C.加入等体积0.2 mol·L-1氨水
D.降低溶液的温度
参考答案:A
本题解析:
试题分析:A.加入适量的氢氧化钠固体,可以使溶液中c(OH-)增大,可能使溶液的pH由a→(a+1).正确。B.将溶液稀释到原体积的10倍,溶液的pH减小,不可能变为(a+1)。错误。C.加入等体积0.2 mol·L-1氨水,氨水的浓度为(0.1+0.2)mol/L÷2=0.15mol/L.氨水浓度增大,溶液的pH增大,但是也不可能增大1个单位。错误。D.氨水中的一水合氨是弱电解质。降低温度,电离程度减小,电解质电离的程度越小,溶液中的c(OH-)越小,pH就越小。错误。
考点:考查影响弱电解质电离平衡的因素的知识。
本题难度:一般
2、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| HA物质的量
浓度(mol·L-1)
| NaOH物质的量
浓度(mol·L-1)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| C1
| 0.2
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=9
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,若a??????7(填>、<或=),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度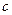 (A-)与 (A-)与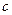 (Na+)的大小关系是????????。 (Na+)的大小关系是????????。
A.前者大
B.后者大
C.二者相等
D.无法判断
(3)从丙组实验结果分析,HA是?????酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是??????????????????????????????。
(4)丁组实验所得混合溶液中由水电离出的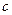  =???????????mol·L-1。 =???????????mol·L-1。
参考答案:(每小题3分)(1)>?(2)C?(3)弱? Na+>A->
本题解析:(1)若HA是弱酸,则恰好反应后是强碱弱酸溶液,呈碱性。(2)、根据电荷守恒有:c(Na+)+c(OH-)=c(H+)+c(A-) ,pH=7时,c(OH-)=c(H+),所以c(Na+)= c(A-)。
(3)丙组中HA酸过量,但溶液显碱性,所以HA是弱酸。
(4)因溶液pH=9,c(OH-)=10-6mol/L,全部来源于水的电离。
本题难度:一般
3、选择题 下列各组离子一定能大量共存的是
A.NH4+、H+、-、Cl-
B.Fe3+、K+、CO32-、NO3-
C.K+、Al3+、Cl-、OH-
D.K+、Ba2+、NO3-、OH-
参考答案:D
本题解析:B Fe3+、CO32-不能大量共存。
C Al3+、OH-不能大量共存
D 能大量共存
本题难度:一般
4、选择题 已知室温时,0.1mo1/LCH3COOH在水中有0.1%发生电离,下列叙述正确的是:
A.该溶液的pH=5
B.由CH3COOH电离出的c(H+)约为水电离出的c(H+)的106倍
C.CH3COOH的电离平衡常数约为1×10-6
D.升高温度,溶液的pH增大
参考答案:B
本题解析:
试题分析:0.1mo1/LCH3COOH在水中有0.1%发生电离,即c(H+)= c(CH3COO-)=0.1%×0.1mo1/L=10-4 mo1/L。pH=4,A不正确;因Kw=c(H+)·c(OH-)水=10-14,故c(OH-)水=c(H+)水=10-10 mo1/L,B正确;Ka= c(H+)·c(CH3COO-)/ c(CH3COOH)= 10-4×10-4/(0.1-10-4)= 1×10- 本题难度:一般 本题难度:一般
5、选择题 下列有关叙述正确的是 (??)
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO )+c(H2CO3) )+c(H2CO3)
B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍
C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强
D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-)
参考答案:B
本题解析:
试题分析:A、根据元素守恒规律,应有c(HClO)+c(ClO-)= c(HCO )+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶 )+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶
本题难度:一般
|