微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于实验现象的描述不正确的是[???? ]
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把铁片敢入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:C
本题解析:
本题难度:一般
2、选择题 在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42—从右到左通过交换膜移向M极,下列分析正确的是
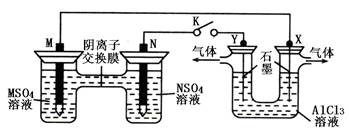
A.溶液中c(M2+)减小
B.N的电极反应式:N=N2++2e—
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
参考答案:C
本题解析:
试题分析:A、当K闭合时,由图可知,左侧为原电池,右侧为电解池装置,SO42—从右到左通过交换膜移向M极,说明M极是原电池的负极,N是原电池的正极;M的活动性大于 N,原电池的总反应是M置换N,所以溶液中c(N2+)减小,错误;B、N 是原电池的正极,发生还原反应,N2+得电子生成N,电极反应式为N2++2e—=N,错误;C、右侧为电解池装置,X与负极相连,是电解池的阴极,发生还原反应,阳离子放电,所以是溶液中的氢离子放电生成氢气,正确;D、X极产生氢气,导致氢氧根离子浓度增大,所以氢氧根离子与溶
本题难度:一般
3、选择题 对于原电池的电极名称叙述有错误的是 ( )
A.发生氧化反应的为负极
B.正极为电子流入的一极
C.电流的方向由正极到负极
D.比较不活泼的金属为负极
参考答案:D
本题解析:考查原电池的有关判断。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,所以选项D不正确,其余都是正确的,答案选D。
本题难度:简单
4、填空题 (15分)A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
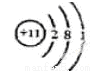
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的化合物甲反应的离子方程式 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极。
(7) E(s)+O2(g) EO2(g) △H1 E(g)+O2(g) EO2(g) △H2,
则△Hl △H2(填“>”或“<”或“=”)。
参考答案:
(1) 本题解析:
本题解析:
试题分析:根据题意知,A、B组成的气态化合物的水溶液呈碱性,则A是H元素,B是N元素,二者形成的化合物是氨气,水溶液呈碱性;A、D都能与C按原子个数比为1:1或2:1形成化合物,则D是Na,C是O,形成的化合物氧化物与过氧化物均是原子个数比为1:1或2:1,E与C的最外层电子数相同,则E是S元素。(1)D为钠元素,原子结构示意图为
 ,
,
E为硫元素,在周期表中的位置是第3周期第ⅥA族;(2)A与C形成原子个数比为1:1的化合物甲是过氧化氢,化学键类型是共价键;(3)D与C按原子个数比为1:1形成化合物是过氧化钠,属于离子化合物,电子式为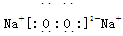 ;(4)N的非金属性比O弱,所以B、C所形成氢化物水的稳定性大于氨气,稳定性由强到弱的顺序是H2O、NH3;(5)F金属投入到盐酸溶液中,生成了浅绿色溶液M,则M是氯化亚铁,F是Fe,氯化亚铁与过氧化氢在酸性条件下发生氧化还原反应,生成铁离子和水,离子方程式为2Fe2++H2O2+2H+=2Fe3++H2O;(6)以氢气、氮气为原料的电池的正极是氮气发生还原反应,结合电解质溶液氮气得电子与氢离子结合生成铵根离子,电极反应式为N2+6e-+8H+=2NH4+;原电池中的阳离子移向正极,所以放电时溶液中H+移向正极;(7)固体熔化为液体需要吸热,所以气态S完全燃烧放出的热量多,则△Hl>△H2。
;(4)N的非金属性比O弱,所以B、C所形成氢化物水的稳定性大于氨气,稳定性由强到弱的顺序是H2O、NH3;(5)F金属投入到盐酸溶液中,生成了浅绿色溶液M,则M是氯化亚铁,F是Fe,氯化亚铁与过氧化氢在酸性条件下发生氧化还原反应,生成铁离子和水,离子方程式为2Fe2++H2O2+2H+=2Fe3++H2O;(6)以氢气、氮气为原料的电池的正极是氮气发生还原反应,结合电解质溶液氮气得电子与氢离子结合生成铵根离子,电极反应式为N2+6e-+8H+=2NH4+;原电池中的阳离子移向正极,所以放电时溶液中H+移向正极;(7)固体熔化为液体需要吸热,所以气态S完全燃烧放出的热量多,则△Hl>△H2。
考点:考查元素的判断,元素及其化合物的性质应用,电化学反应原理、热效应的判断
本题难度:困难
5、选择题 下列装置中能组成原电池形成电流的是( )
参考答案:C
本题解析:略
本题难度:一般