微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
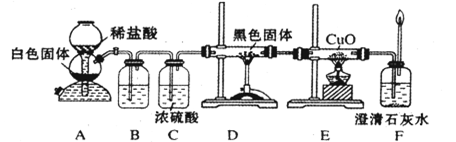
1、实验题 (10分)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2O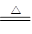 CO+H2?? CO + H2O
CO+H2?? CO + H2O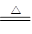 ?CO2 + H2?? C + CO2
?CO2 + H2?? C + CO2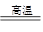 2CO
2CO
试回答下列问题:
①装置B中最适宜的试剂是???????????????,必须用装置C吸收气体中的水蒸气的理由是????????????????????????????????????????????????;
②根据该实验中的?????????????????????????????现象,可证明CO具有还原性;
③若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置????与?????之间(填字母标号)连接右图中的??????????装置(选填序号)。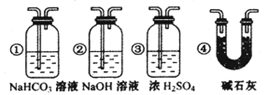
参考答案:①饱和NaHCO3溶液(2分)?防止水蒸气与炭反应生成的氢气
本题解析:(1)由于A中生成CO2中含有氯化氢,所以B的作用是除去氯化氢,用饱和碳酸氢钠溶液除氯化氢。由于在高温下,水蒸气能和碳反应生成氢气和CO,所以浓硫酸的作用是防止水蒸气与炭反应生成的氢气对实验现象产生干扰。
(2)CO还原氧化铜,生成CO2和铜,所以如果 E装置中黑色CuO变成红色即说明CO具有还原性。
(3)由于CO2和碳反应时,CO2不可能完全被吸收,所以要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应该除去多余的CO2,所以应在上图装置D和E之间连接④。
本题难度:一般
2、选择题 下列装置可以用作实验室制取乙炔气体的反应装置的是
A.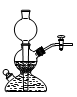
B.
C.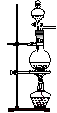
D.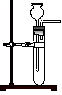
参考答案:B
本题解析:实验室利用碳化钙与食盐水常温下反应制取乙炔气体,不用酒精灯加热,排除C。因为该反应剧烈,放热多,而且生成的氢氧化钙呈糊状,易堵塞启普发生器或其简易装置的下端管口,故排除A、D。
故选B
本题难度:一般
3、实验题 (12分)硫酸亚铁铵(NH4)2SO4?FeSO4?6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
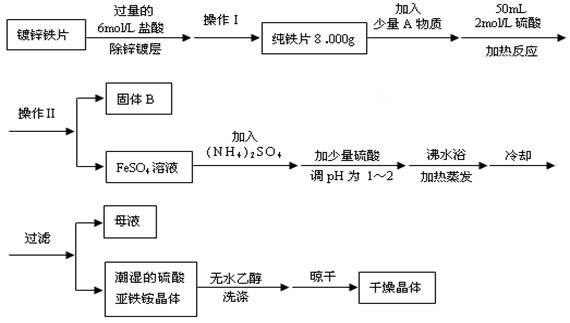
请回答下列问题:
(1)确定锌镀层被除去的标志是?????????????????????????;
计算上述铁片锌镀层的厚度,不需要的数据是????????????(填编号)。
a.锌的密度ρ(g/cm3)????? b.镀锌铁片质量m 1(g)?? c.纯铁片质量m 2(g)
d.镀锌铁片面积S(cm2)??? e.镀锌铁片厚度h(cm)
(2)上述流程中:操作Ⅰ是取出铁片、???????、????????、称量。
(3)A物质可以为????????(填编号)。
a.CuCl2?????? b.CuO?????? c.Cu(NO3)2?????? d.CuSO4??
(4)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是???????????????????。
(5)鉴定所得晶体中含有Fe2+、NH4+、SO42-离子的实验方法正确的是?????(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
参考答案:(12分)(1)反应速率突然减小(或铁片表面生成的气泡突然减
本题解析:(1)两金属均可置换出氢气,但锌的金属活性较铁强,故当铁片表面生成的气泡突然减少时,表明锌镀层已被除去
锌层的质量为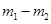 ,其体积为
,其体积为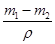 ,由于锌层为两面,故锌层厚度为
,由于锌层为两面,故锌层厚度为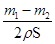 ,故计算锌镀层的厚度不需要“镀锌铁片厚度”
,故计算锌镀层的厚度不需要“镀锌铁片厚度”
(2)操作I:为了提高实验精度,必须将铁片表面洗涤干净,再干燥后称量
(3)由于原电池反应速率快于化学反应,同时为不引入杂质,故可通过加入CuO或CuSO4形成铁铜原电池,以加快反应速率
B物质是过量的铁及置换出铜
(4)由于产品易分解并且易被氧化,故尽量不加热
(5)a:即使不含有Fe2+,最终也可出现血红色,不正确
b:通过生成白色沉淀及沉淀颜色的变化,可检验出Fe2+的存在,正确
c:氨气逸出,试纸颜色变蓝,正确
d:可以检验出SO42―离子的存在,正确
本题难度:一般
4、实验题 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
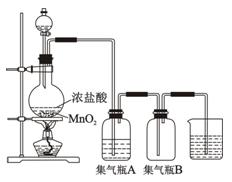
试回答下列问题:
(1)该反应是氧化还原反应吗?①???????(填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是???????????,③还原剂是?????????????,④写出该反应的离子 方程式?????????????????????????????????????????????????????????????。
方程式?????????????????????????????????????????????????????????????。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是????????????????????????????。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用???????????溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
参考答案:(1)① 是;② MnO2;③ 浓盐酸;
④ 4H
本题解析:略
本题难度:简单
5、实验题 下列装置为中学化学实验常用的气体制备装置
 ???????
??????? ??????
??????
A???????????? B????????? C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 ???????????。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 ????????????????。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置???????????。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置?????????。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 ?????????????????????????????????????????????????????????????。
写出氯气和氯化亚铁溶液反应的离子方程式:???????????????????????????????????。
③请写出氯气尾气处理的离子方程式 ????????????????????????????????????????????。
参考答案:(1)A(2)C(3)A (4)① A ②取洗气瓶中C中的溶
本题解析:
试题分析:(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置是固体和固体需要加热的,因此符合条件的是选项C。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(4)①根据反应的方程式可知Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2+2H2O,该反应是固体和液体之间不需要加热制备气体的,所以应该选择装置A。
②由于亚硫酸钡不溶于水,但能溶于水酸中。而硫酸钡不溶于水,也不溶于酸,所以证明亚硫酸钠已经被氧化实验方法是取洗气瓶中C中的溶液少许,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀,则证明Na2SO3已被氧化;氯气和氯化亚铁溶液反应的离子方程式是Fe2++ Cl2=2 Fe3++2 Cl-。
③氯气有毒,需要尾气处理,一般用氢氧化钠溶液吸收,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+ 2H2O。
点评:本题主要是考查学生对于装置的选取方法的应用及方程式的书写等知识,可以很好的考查学生对于知识的理解和应用能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的应试能力和学习效率。
本题难度:一般