微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有如下两个反应:
(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池
(A) ; (B) ;(填“能”与“不能”)
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是 ; 电解质溶液是 。
②写出电极反应式:负极 ;正极 。
③若导线上转移电子1mol,则负极质量变化 g。
参考答案:(每空1分,共7分)
(1)(A)不能;(B)能 ;
本题解析:
试题分析:(1)原电池中发生的是氧化还原反应,故(A)不能;(B)能。
(2)①负极和电解液发生反应时失去电子,化学价升高,发生氧化反应,故负极材料是铜片,电解液是FeCl3溶液。
②负极失去电子,电极式为Cu-2e-=Cu2+;正极得到电子,电极式为2Fe3++2e-=2Fe2+。
③根据电极式计算,若导线上转移电子1mol,则负极物质的量变化为0.5mol,质量为32g。
考点:原电池
点评:本题考查了以原电池原理设计原电池,难度较大,原电池的设计是学习的重点和难点,明确原电池的工作原理是设计原电池的关键。
本题难度:一般
2、填空题 低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 850
|
平衡常数
| 9.94
| 9
| 1
请回答下列问题:
(1)上述正反应方向是??????反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)。
t1℃时物质浓度(mol/L)的变化
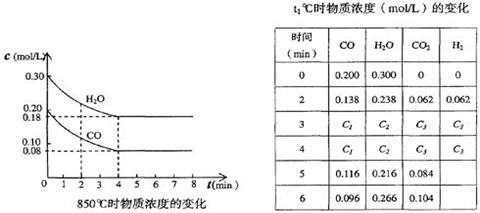
时?间(min)
| CO
| H2O
| CO2
| H2
| 0
| 0.200
| 0.300
| 0
| 0
| 2
| 0.138
| 0.238
| 0.062
| 0.062
| 3
| C1
| C2
| C3
| C3
| 4
| C1
| C2
| C3
| C3
| 5
| 0.116
| 0.216
| 0.084
| ?
| 6
| 0.096
| 0.266
| 0.104
| ?
(3) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气?????? B.降低温度??? C.使用催化剂????? D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:???????????。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为???????????????????。
(6) 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g)???????????????????△H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g)?????△H = -534.0 kJ·mol-1
NO2(g) 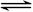 1/2N2O4(g)???????????????????△H = -26.35 kJ·mol-1 1/2N2O4(g)???????????????????△H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
________________________________________________________。
参考答案:(1)放热?(2分)(2)0.03 (2分)?
(3)
本题解析:(1)根据表中数据可知,随着温度的升高,平衡常数逐渐减小,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应。
(2)根据图像可知,在0~4 minCO的浓度减少了0.2mol/L-0.08mol/L=0.12mol/L,所以反应速率是0.12mol/L÷4min=0.03mol/(L·min)。
(3)①在3 min~4 min之间,物质的浓度不再发生变化,所以反应达到平衡状态。由于正反应是放热反应,所以升高温度,平衡向逆反应方向移动,因此平衡时C1大于0.08 mol/L。
②
本题难度:一般
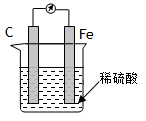
3、选择题 下列说法正确,且能用原电池原理解释的是( )
A.合金一定比纯金属耐腐蚀
B.如图,在铁棒上产生气泡,碳棒上没有气泡
C.在锌与稀硫酸反应时,加入硫酸铜溶液可以加快反应速率
D.铝不需要特别处理就具有抗腐蚀能力
参考答案:C
本题解析:合金的耐腐蚀和原电池无关。B中是原电池,但铁作负极,失去电子,碳棒是正极,氢离子在正极得到电子,生成氢气。C中锌把铜离子置换出来生成铜,构成原电池,锌是负极,加快反应速率,正确。铝明白能形成一层致密的氧化膜,从而阻止铝被腐蚀。答案选C。
本题难度:一般
4、填空题 锌锰干电池是普遍使用的化学电源,其中含有MnO2、NH4Cl、ZnCl2等糊状物。以锌筒为负极材料,石墨为正极材料。一节干电池电动势和内电阻分别为g=1.5V,r=0.25Ω,它对外供电时效率 =75%。干电池的工作原理是: Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑+ H2O
(1)试写出干电池放电时的正、负极反应式。正极_____________;负极_____________。
(2)正极反应中,前后经历了下列两个反应:2NH4++2e-=2NH3↑+H2↑ 2MnO2+H2=Mn2O2+H2O 如果正极反应没有MnO2的参与,干电池将难以持续稳定工作。试说明理由:____________________________________。
(3)在通电10min内参加反应的MnO2质量约为多少?外电阻消耗的电能是多少?
______________________________
(4)许多国家对废旧电池进行回收,从保护环境和节约能源的角度解释为什么要回收废旧电池?__________________________
参考答案:(1)2MnO2+2NH4++2e-=Mn2O3+2NH3↑
本题解析:
本题难度:一般
5、填空题 唐山市百货大楼热销的新型“海尔”牌热水器,为延长内胆(钢板制)的使用寿命,采用内胆焊接金属镁棒新技术,此技术利用了原电池原理,可以防止内胆的锈蚀。
书写该原电池的电极反应式: 负极:__________ ; 正极:__________ 。
参考答案:负极 Mg-2e-==Mg2+?? ;正极 O2+2H2O+
本题解析:
本题难度:一般
|
|