35Cl 37Cl
(3)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
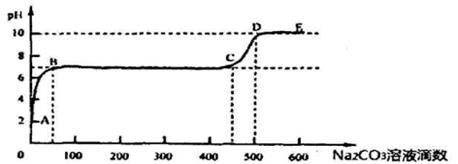

请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
参考答案:(1)二 、IVA 、 14C (每空1分,共3分)
本题解析:
试题分析:(1)C元素位于元素周期表第二周期,IVA族,常用14C测定文物年代,这种同位素的符号为14C;
(2)N3-与 Al3+的电子层结构相同,则原子序数小的离子半径大,所以离子半径:N3-大于Al3+;O的氧化性大于S,则O2-的还原性小于S2-;35Cl与 37Cl都是Cl元素的不同原子,化学性质相似,所以得电子能力相同;
(3)①CaCO3和适量HCl溶液反应时生成二氧化碳气体,氯化钙、水,所以4.4g二氧化碳的物质的量是4.4g/44g/mol=0.1mol,则1mol碳酸钙与适量HCl溶液反应放出的热量是10akJ,则该反应的热化学方程式为CaCO3(s)+ 2HCl(aq)= CaCl2(aq)+ H2O(l) +CO2(g)?H =" -10a" kJ/mol;
②因为二氧化碳能溶于水,使氯化钙溶液显酸性,所以开始加入的碳酸钠与溶解的二氧化碳反应,BC段的pH保持不变,说明此时加入的碳酸钠与氯化钙反应生成碳酸钙沉淀,离子方程式为Ca2++ CO32-= CaCO3↓;
(4)氢氧燃料电池中负极发生氧化反应,所以在负极发生反应的是氢气,电解质溶液是氢氧化钠,则氢气失去电子,与电解质溶液中的氢氧根离子结合为水,所以负极的电极反应式为H2-2e-+2OH- = 2H2来源:91考试网 91ExaM.orgO。
考点:考查元素位置的判断,离子半径、还原性的判断,热化学方程式的书写,原电池电极反应式的书写
本题难度:困难
2、选择题 如图所示,a、b是两根石墨棒.下列叙述正确的是( )
A.稀硫酸pH增大
B.饱和食盐水pH减小
C.a是正极,发生还原反应
D.往滤纸上滴加酚酞试液,a极附近颜色变红
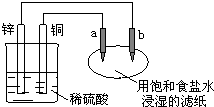
参考答案:A
本题解析:
本题难度:简单
3、选择题 一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 =" 2" CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是

A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是负极
C.该电池的正极反应为:4H+ + O2 + 4e-= 2H2O
D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L
参考答案:A
本题解析:
试题分析:放电时负极流出的电子通过外电路流入正极,电子带负电,则内电路中的阴离子从正极移向负极、阳离子从负极移向正极,故A错误;乙醇发生氧化反应,失去电子,所含碳元素的化合价升高,故B正确;酸性条件下氧气发生还原反应,得到电子,根据电子、电荷和原子守恒原理,故C正确;C2H5OH+3O2 =2CO2 +3H2O~12e-,则n(e-)转移=12×0.2 mol,阳极反应式为2Cl-—2e-=Cl2↑,根据电子守恒原理,则n(Cl2)= n(e-)转移/2=12×0.2 mol/2=1.2mol,V
本题难度:一般
4、选择题 在原电池中,正、负极发生的反应分别是
A.氧化反应、还原反应
B.氧化反应、氧化反应
C.还原反应、还原反应
D.还原反应、氧化反应
参考答案:D
本题解析:
本题难度:简单
5、选择题 工业上常用Fe作电极电解处理含Cr2 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是(??) 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是(??)
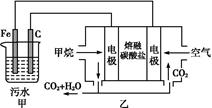
A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L
B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C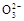
D.甲中阳极附近溶液中的离子反应方程式是:Cr2 +6Fe2++14H+=2Cr3++6Fe3++7H2O +6Fe2++14H+=2Cr3++6Fe3++7H2O
参考答案:A
本题解析:乙为原电池,作电源用,甲为电解池。乙中甲烷一极为负极,空气一极为正极,则甲中Fe为阳极,C为阴极,A项由于未指明标准状况,气体体积无法计算;由图中乙中正极进入的物质为空气和CO2,知此两者为反应物,则电极反应为:O2+4e-+2CO2=2C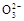 ,负极反应为:CH4-8e-+4C ,负极反应为:CH4-8e-+4C 本题难度:一般 本题难度:一般
|