微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案:???????????????????????????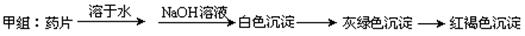 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:

(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁??
②?????????????????????????????????????????????????????????????????。
(3)请你对其中一种可能 进行实验验证:________________________________
进行实验验证:________________________________
实验方案(用文字述):________________________________________________ ,
根据预期现象判断结论:________________________________________________________ 。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
序号
| V(KMnO4)初
| V(KMnO4)终
| V(KMnO4)
|
1
| 2.24mL
| 14.25mL
| 12.01mL
|
2
| 0.30mL
| 12.72mL
| 12.42mL
|
3
| 0.50mL
| 12.53
| 12.03mL
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。
参考答案:(12分)(1)该药片在水中溶解度不大,少量溶解后的溶液中几
本题解析:略
本题难度:一般
2、简答题 下面是提纯大理石(主要杂质是氧化铁)的流程图: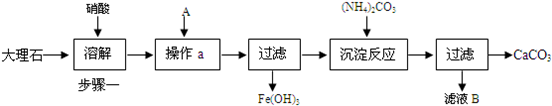
按要求回答下列问题:
(1)为加快步骤一中的固体溶解,可采取的措施有______把工业大理石研成粉末(只写一点).
(2)操作a中A物质最好应选择______(填化学式).在该过程中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______.
(3)检验Fe3+已完全生成Fe(OH)3沉淀的方法是:______.
(4)若将滤液B中的溶质回收再用,除了得到NaNO3外,还可能得到______(填化学式).
参考答案:由流程可知,大理石、氧化铁和硝酸反应,固体溶解,为除去杂质,
本题解析:
本题难度:简单
3、实验题 某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
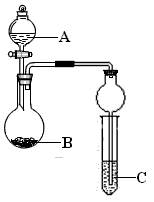
(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,原因是__________ (结合离子方程式回答)。一段时间后,观察到试管中的现象是___________ ,发生反应的离子方程式是______________ 。
(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,A与B发生反应的离子方程式是____________ ,能得到的相应结论是_____________ ;试管中出现浑浊,依据此现象能否得出相应的结论,请简述理由:_______________ 。
参考答案:(1)在氨水中有下列平衡:NH3+H2O![]()
本题解析:
本题难度:一般
4、填空题 以黄铜矿(CuFeS2)为原料冶炼铜的反应为:
8CuFeS2+21O2
(1)若Cu为+2价,则反应中每生成1molCu需要转移?????????????mol电子。
(2)为综合利用炉气中的大量SO2,下列方案合理的是???????????。
a.用浓硫酸吸收???????? b.用于制备硫酸
c.高空排放???????????? d.用纯碱液吸收制亚硫酸钠
(3)为检验所得矿渣是中是否含有FeO、Fe2O3、CuO、A12O3、SiO2等氧化物,进行了以下实验;
①取一定量矿渣粉末,加入适量浓硫酸后加热,固体全部溶解,得溶液A;将产生的气体通入品红溶液中,溶液褪色。由此判断矿渣中一定含有?????????,一定没有??????。
②将溶液A稀释后分成两份,取其中一份,加入过量NaOH溶液,有沉淀产生,静置后取上层清液,通入过量的CO2溶液变浑浊。由此判断出矿渣中含有?????????,写出通入过量的CO2所发生反应的离子方程式:??????????????。
③取另一份溶液A加入过量的铁粉充分反应后过滤,得到的固体中有红色物质,由此判断矿渣中有?????????????,写出此步操作中得到红色物质所发生反应的离子方程式????????????。
参考答案: 本题解析:略 本题解析:略
本题难度:一般
5、选择题 下列实验操作中,正确的是
A.稀释浓H2SO4时,将蒸馏水沿容器内壁缓慢倒入浓H2SO中,并及时搅拌
B.测定溶液pH时,用洁净的玻璃棒蘸取待测液点在pH试纸上,观察试纸的颜色变化,并与标准比色卡相比较
C.称量NaOH固体时,将NaOH固体放在垫有滤纸的托盘上
D.在蒸发NaCl溶液得到NaCl晶体的实验中,必须待蒸发皿中的水分全部蒸干后才能撤去酒精灯
参考答案:B
本题解析:
试题分析:稀释浓H2SO4时,将能熟练沿容器内壁缓慢倒入水中,并及时搅拌,A不正确;氢氧化钠易潮解,且检验腐蚀性,应该放在烧杯中称量,C不正确;D不正确,蒸发时如果出现大量的晶体是就应该停止加热,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:简单
|