微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下
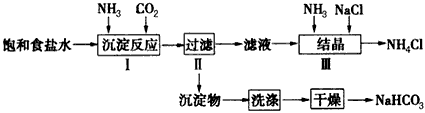
请回答:
(1)为了制取I、Ⅲ中需用的氨气,某同学设计了如图1 所示装置
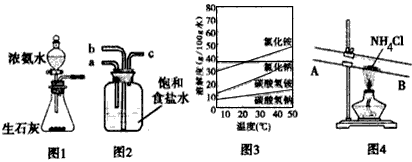
试简述将浓氨水滴入锥形瓶中的操作:_________________。
(2)若用图2装置进行该沉淀反应,反应方程式为:NaCl +NH3+CO2+H2O=NaHCO3↓+NH4Cl。实验时,须先从______(填“a”、“b”或“c”)口通入__________。
(3)步骤Ⅲ向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①已知四种相关物质不同温度下的溶解度曲线如图3所示,则结晶时宜采用________(填“蒸发结晶” 或“降温结晶”)。
②某同学设计了如图4所示的装置来验证所得的晶体中含有NH4+。
具体操作:取少量晶体于硬质试管中,对晶体部位加热。并在____(填“A”或“B”)处放置____ 试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等。
①准确称量ag样品溶于水,加入足量沉淀剂。沉淀剂最好选用____。
A.Ca(OH)2溶液 B.CaCl2溶液 C.BaCl2溶液 D.Ba(OH)2溶液
②过滤、洗涤、烘干,冷却、称量,称得固体质量为bg。
③重复以上“烘干,冷却、称量”操作,直至____ 为止。此时称得固体质量为cg。
④计算:样品中NaHCO3的含量为____。
2、实验题 摩尔盐[(NH4)2SO4·FeSO4·6H2O]是一种复盐,它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化。某实验小组查得硫酸铵、七水硫酸亚铁、硫酸亚铁铵的溶解度如下表
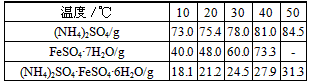
该实验小组在实验室按下列流程进行制取摩尔盐的实验:

(1)为了加快铁屑的溶解,可加入少量的________ (填物质名称)。
(2)反应I进行后要“趁热过滤”,其目的是:__________________。实验中要在反应Ⅱ的溶液中加入少量稀硫酸,其作用是:_________________。
(3)反应Ⅱ后的溶液经蒸发等操作所得固体用乙醇洗涤的目的是:___________________。
(4)在摩尔盐溶液中加入足量氨水,反应的离子方程式为:_______________
3、实验题 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
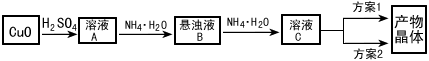
相关信息如下:
①[Cu(NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下:

请根据以下信息回答下列问题
(1)方案1的实验步骤为: a. 加热蒸发 b. 冷却结晶 c. 抽滤 d. 洗涤 e. 干燥
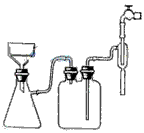
步骤1的抽滤装置如图(右)所示,该装置中的错误之处是_________________;抽滤完毕或中途停止抽滤时,应先____________,然后______________。该方案存在明显缺陷,因为得到的产物晶体中往往含有____________杂质,产生该杂质的原因是_____________________。
(2)方案2的实验步骤为:
a. 向溶液C中加入适量____________,b.______________,c. 洗涤,d. 干燥
①请在上述内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________________。(填序号)
A. 乙醇 B. 蒸馏水 C. 乙醇和水的混合液 D. 饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是__________________________。
4、实验题 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题
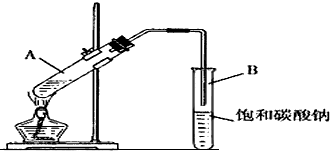
(1)写出制取乙酸乙酯的化学反应方程式_____________________。
(2)浓硫酸的作用是:①________________;②________________。
(3)饱和碳酸钠溶液的主要作用是________________________________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止________________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是________________。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
5、实验题
|
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80℃,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
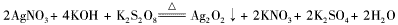 ?
?
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是___________________。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的转化为Ag,负极的Zn转化为
K2Zn(OH)4,写出该电池反应方程式:________________________。
(3)准确称取上述制备的样品(设Ag2O2仅含和Ag2O)2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mL O2(标准状况下)。计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位)。