微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中,Na+ 浓度最大的是( )
A.1mol/L Na2SO4溶液200mL
B.0.9mol/L Na3PO4溶液200mL
C.2.5mol/L NaOH 溶液100mL
D.1mol/L NaHCO3溶液300mL
参考答案:B
本题解析:
试题分析:根据电解质的化学式可知,A中钠离子浓度是1mol/L×2=2.0mol/L;B中是0.9mol/L×3=2.7mol/L;C中是2.5mol/L;D中是1mol/L,所以答案选B。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确电解质电离出的离子和电解质个数的关系,然后直接列式计算即可。
本题难度:简单
2、选择题 常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3—、SO42—、Na+
B.由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl—、HCO3—
C.c(H+)/c(OH—)=1012的溶液中:NH4+、Al3+、NO3—、Cl—
D.c(Fe3+)="0.1" mol·L-1的溶液中:K+、ClO—、SO42—、SCN—
参考答案:C
本题解析:
试题分析:A、pH=1的溶液为酸性溶液,在酸性溶液中,H+、NO3—与Fe2+因发生氧化还原反应不能大量共存,错误;B、由水电离出的c(H+)=1×10-14 mol·L-1<1×10-7 mol·L-1,说明溶液为酸或碱的溶液,在酸性或碱性溶液中HCO3—都不能大量共存,错误;C、c(H+)/c(OH—)=1012的溶液中c(H+)=0.1mol/L,溶液为酸性,四种离子均不发生反应,可以大量共存,正确;D、铁离子与SCN—发生络合反应不能大量共存,错误,答案选C。
考点:考查离子的大量共存的判断
本题难度:一般
3、选择题 下列各组离子,在水溶液中能大量共存的是
A.K+、H+、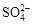 、OH-
、OH-
B.Na+、H+、Cl-、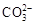
C.Na+、Ca2+、 、
、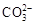
D.Na+、Cu2+、Cl-、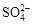
参考答案:D
本题解析:
试题分析:A项中H+和OH-不能大量共存;B项中H+和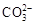 不能大量共存;C项中Ca2+和
不能大量共存;C项中Ca2+和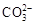 不能大量共存。答案选D
不能大量共存。答案选D
本题难度:简单
4、选择题 在下列实验方法中,不能证明醋酸是弱酸的是
A.25 ℃时,醋酸钠溶液呈碱性
B.25 ℃时,0.1 mol·L-1的醋酸的pH约为3
C.25 ℃时,等体积的盐酸和醋酸,前者比后者的导电能力强
D.25 ℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多
参考答案:C
本题解析:25 ℃时,醋酸钠溶液呈碱性,是醋酸根水解所造成的,能说明醋酸是弱酸。25 ℃时,0.1 mol·L-1的醋酸的pH约为3,得知醋酸溶液中c(H+)小于0.1 mol·L-1,说明醋酸分子未完全电离,是弱酸。溶液的导电能力大小与溶液中离子浓度大小有关。25 ℃时,等体积的盐酸和醋酸,前者比后者的导电能力强,只能说明前者自由移动的离子浓度大于后者,不能说明二者的电离程度大小,即不能证明醋酸为弱酸。25 ℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多,说明醋酸溶液存在电离平衡,是弱酸。故
本题难度:简单
5、选择题 在指定的溶液中一定可以大量共存的离子组是( )
A.使石蕊变红的溶液中:Na+、Fe3+、Cl-、SO42-
B.存在大量S2-的溶液中:Na+、H+、Cu2+、Cl-
C.存在大量A13+的溶液中:Na+、HCO3-、Cl-、SO42-
D.由水电离出来的c(H+)=1×10-13mol/L的溶液中:K+、AlO2-、Cl-、NO3-
参考答案:A.使石蕊变红的溶液,显酸性,该组离子之间不反应,能大量共存
本题解析:
本题难度:一般