微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA代表阿伏加德罗常数,下列有关叙述正确的是( )
A.标准状况下,2.24 L CH2Cl2中含有 C—H 键数为 0.2 NA
B.常温下,100 mL 1 mol?L-1 Na2CO3溶液中阴离子总数大于 0.1 NA
C.分子数为NA的 CO、C2H4混合气体体积约为 22.4 L,其质量为 28 g
D.3.4 g NH3中含 N—H 键数目为 0.2 NA
参考答案:B
本题解析:
试题分析:A项CH2Cl2是液体,不能用22.4L表示体积,C项,没有标明温度和压强,D项1个NH3分子中含有3个N—H,3.4 g NH3中含有0.6NA。答案选B。
考点:阿伏伽德罗常数
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:困难
2、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1 时,三种溶液中Cl—的物质的量之比为
A.1∶1∶1
B.1∶2∶3
C.3∶2∶1
D.3∶4∶3
参考答案:D
本题解析:
试题分析:NaCl、MgCl2、AlCl3三种溶液物质的量浓度相同,体积比为3∶2∶1时,三种溶液中Cl—的物质的量之比为3×1∶2×2∶1×3=3∶4∶3。所以正确选项为D。
考点:考查溶质的浓度与电离产生的离子的浓度的关系的知识。
本题难度:一般
3、选择题 下列溶液中有关物质的量浓度关系和计算不正确的是 ( )
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(NaHCO3)
<c(CH3COONa)
B.已知25°C时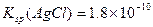 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质
的量浓度最大可达到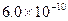 mol·L-1
mol·L-1
C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶
液中水电离出来的OH-浓度
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有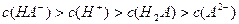
参考答案:D
本题解析:选项D,HA-是弱电解质离子,且HA-的电离大于水解,故应该是c(A2-)>c(H2A)。选项A,当pH相等时,原来碱性强的物质,浓度反而小;原来碱性弱的物质,浓度反而大;故选项A正确。选项B,根据c(Ag+)·c(C1—)=Ksp=1.8×10 -10,将c(Cl-)="0.3" mol.L-l代入式中计算即可。选项C,Na2CO3水解,促进水电离,NaOH是碱,抑制水电离。
本题难度:一般
4、选择题 某溶液中只有Na+、Al3+、Cl-、SO42-四种离子.已知Na+、Al3+、Cl-的个数比3∶2∶1,则溶液中Al3+与SO42-的个数比为
A.1∶2
B.1∶4
C.3∶4
D.3∶2
参考答案:A
本题解析:
试题分析:由电荷守恒可知,设溶液中Na+的个数为3,则SO42-的个数为(2×3+3-1)/2=4,所以溶液中Al3+与SO42-的个数比为2:4=1:2,答案选A。
考点:电荷守恒,电解质溶液
本题难度:一般
5、选择题 下列叙述正确的是????????????????????????????????????(??????)?
A.1molO2的质量为32g/mol
B.1mol物质的质量等于该物质的相对分子质量
C.SO42-的摩尔质量为96g/mol
D.1mol CO2的体积是22.4L
参考答案:C
本题解析:略
本题难度:简单