微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。
(1)火箭常用N2H4作燃料,N2O4作氧化剂。已知:
N2(g) + 2O2(g)=2NO2(g)???????????????????????????????????△H = +67.7 kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g)?????△H =-534.0 kJ·mol-1
NO2(g) 1/2N2O4(g)??????????????????????????????????????△H =-26.35 kJ·mol-1
1/2N2O4(g)??????????????????????????????????????△H =-26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:??????????????????????????????????。
(2)联氨——空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。该电池放电时,正极的电极反应式为 ??????。
(3)在300℃时,改变起始反应物中氢气的物质的量对反应N2(g) + 3H2(g) ?2NH3(g)?△H<0的影响如图所示。
?2NH3(g)?△H<0的影响如图所示。

①请在图中画出400℃时对应的图像。
②在a、b、c三点中,H2 的转化率最高的是 ?????????(填字母)。
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2???????????? NO+NO2+Na2CO3=2NaNO2+CO2
若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
参考答案:(共15分)
(1)2N2H4(g)
本题解析:(1)根据盖斯定律可知②×2-(①+③×2),即得到反应2N2H4(g) + N2O4 (g)=3N2(g) + 4H2O(g),所以该反应的反应热△H =-534.0 kJ·mol-1×2-67.7 kJ·mol-1+26.35kJ·mol-1×2=-1083.0 kJ·mol-1。
(2)原电池中负极失去电子,正极得到电子,所以正极是氧气得到电子。由于电解质是氢氧化钾,所以正极电极反应式是O2 + 4e-+ 2
本题难度:一般
2、选择题 最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH)?关于此电池,下列说法正确的是( )
A.该电池Zn为负极,ZnO为正极,MnO2催化剂
B.该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时OH-能通过薄层纸片向附着二氧化锰的电极移动
参考答案:A.反应中Zn被氧化,应为原电池的负极,MnO2被还原,应为
本题解析:
本题难度:一般
3、推断题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
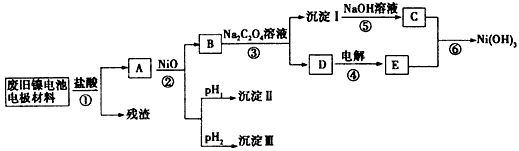 ?
?
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
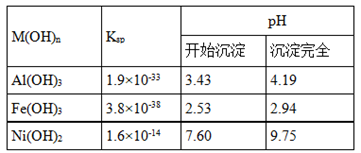
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ??????和沉淀Ⅲ?????(填化学式),则pH1????????pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用??????。
A.pH试纸???????? B.石蕊指示剂?????????? C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是???????????。第③步反应后,过滤沉淀时需要的玻璃仪器有????。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因?????????????、????????????。
(3)④中阳极反应产生的气体E为????,验证该气体的试剂为???????。
(4)试写出反应⑥的离子方程式???????????。
参考答案:(1)Fe(OH)3??? Al(OH)3???<????
本题解析:由题给条件,金属氢氧化物的Ksp及沉淀析出的理论pH,可知,在A溶液中加入NiO是为了调节溶液pH,使相应的铝离子、三价铁离子全部沉淀出,Ni2+在溶液B中.根据pH可以确定开始析出沉淀和全部沉淀的pH范围,先析出沉淀Ⅱ是Fe(OH)3,沉淀pH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以pH1<pH2;控制两种沉淀析出必须准确测定pH值,所以应利用pH计测定。
(2)由溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,结合流程中
本题难度:一般
4、选择题 锰锌干电池在放电时,电池总反应方程式可以表示为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O.在此电池放电时,正极(碳棒)上发生反应的物质是( )
A.Zn
B.碳
C.MnO2和NH4+
D.Zn和NH3
参考答案:锰锌干电池在放电时,发生Zn+2MnO2+2NH4+=Zn2
本题解析:
本题难度:一般
5、选择题 根据下图,下列判断中正确的是(? )
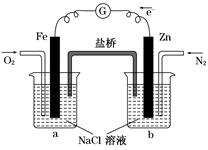
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-=H2
D.烧杯b中发生的反应为2Cl--2e-=Cl2
参考答案:AB
本题解析:由图知,烧杯b中的Zn棒失去电子,发生氧化反应,电子转移到Fe棒上,烧杯a中通入的氧气在Fe棒表面得电子生成氢氧根离子,使a中溶液的pH升高。所以正确的为A、B。
本题难度:一般