微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能使碳酸钙的分解速率显著增大的措施是
A.升高温度
B.增加少量的CaCO3固体
C.加入MnO2
D.增大压强
参考答案:A
本题解析:
试题分析:A.使碳酸钙的分解速率显著增大,应升高温度;B.而碳酸钙为固体,则增加少量的CaCO3固体,反应物浓度不变,反应速率不变;C.该反应无需加入催化剂;D.增大压强,逆反应速率增大,但正反应速率不变,不能使分解速率增大;选A.
考点:考查影响化学反应速率的因素。
本题难度:一般
2、简答题 Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL?0.01mol?L-1KMnO4溶液与2mL?0.1mol?L-1?H2C2O4溶液进行实验,改变条件如下:
| 组别 | 10%硫酸的体积(mL) | 温度/℃ | 其他物质
I
2mL
20
II
2mL
20
10滴饱和MnSO4溶液
III
2mL
30
IV
1mL
20
1mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,使用实验______和______(用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验______和______.
(2)对比实验I和IV,可以研究______对化学反应速率的影响,实验IV中加入1mL蒸馏水的目的是______.
Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol?L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?______(填“是”或“否”),请说明理由______.
(2)滴定时用______(填a或b)滴定管盛装KMnO4标准溶液.
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为______.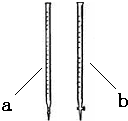
参考答案:Ⅰ.(1)由实验目的可知,探究反应物浓度、温度、催化剂对反应
本题解析:
本题难度:一般
3、实验题 (9分)为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果 ,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题: ,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:

(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果。其结论________(填“合理”或“不合理”)。理由是_______________________。
(2)同学Y利用乙装置,测定相同时间内产生气体的体积,从而探究Fe3+和Cu2+对H2O2分解的催化效果。试回答下列问题:
①仪器A的名称是____ ____。 ____。
②除了必要的试剂和图乙所示的仪器外,还有一样不能缺少的实验用品是___________。
③实验时组装好装置乙,关闭A的活塞,将注射器活塞向外拉出一段。这一操作的实验目的是_______________________。
④测定气体体积时,是否需要事先排除乙装置内的空气________(填“需要”或“不需要”)。
(3)同学Z利用丙装置探究MnO2对H2O2分解的催化效果。将50 mL 双氧水一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)]和
时间(t/min)的关系如图所示。
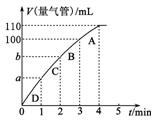
①实验时放出气体的总体积是________mL。
②b________(填“大于”、“小于”或“等于”)90 mL。
③同学Z除了探究MnO2对H2O2分解速率的影响情况,
还可得出________对H2O2分解速率的影响情况。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
4、选择题 改变外界条件可以影响化学反应速率,对反应H2(g)+I2(g)  2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂 2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂
A.①③
B.①④
C.②③
D.③④
参考答案:B
本题解析:
试题分析:①、升高温度,活化分子百分数增多,正确;②增加反应物浓度就增加了单位体积的活化分子的数目,从而增加有效碰撞,反应速率增加,但活化分子百分数是不变的 ,错误;③对于有气体参与的化学反应,其他条件不变时(除体积),增大压强,即体积减小,反应物浓度增大,单位体积内活化分子数增多,但活化分子百分数是不变的,错误;④催化剂改变化学反应速率是降低了反应的活化能,活化分子百分数增多,正确;选B。
考点:考查化学反应中能量转化的原因。
本题难度:一般
5、选择题 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )
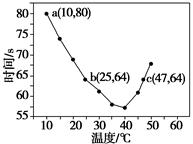
A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1
D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂
参考答案:B
本题解析:A.由图像可知,40 ℃之前温度越高溶液变蓝所需要的时间越短;40 ℃之后温度越高溶液变蓝所需要的时间越长,其变化趋势相反。B.b、c两点的温度不同,所以反应速率不相等。C.当溶液变蓝时发生反应IO3—+5I-+6H+=3I2+3H2O,此时反应6HSO3—+2IO3—=6SO42—+2I-+6H+恰好结束,即溶液变蓝时NaHSO3恰好完全反应,v(NaHSO3)=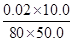
本题难度:一般
|