微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下列物质的性质,判断其应用错误的是(???)
A.明矾水解时产生具有吸附性的胶体粒子,可作自来水的净水剂
B.CaO能与SO2反应,可作工业废气的脱硫剂
C.浓硫酸、浓硝酸具有强氧化性,在常温下可用铁、铝制容器来盛装浓硫酸或浓硝酸
D.铜的金属活泼性比铁的弱,可在海轮外壳上焊若干铜块以减缓其腐蚀
参考答案:D
本题解析:
试题分析:A、明矾水解时产生具有吸附性的胶体粒子,可作自来水的净水剂,正确;B、CaO能与SO2反应生成亚硫酸钙,进一步氧化为硫酸钙,可作工业废气的脱硫剂,正确;C、浓硫酸、浓硝酸具有强氧化性,常温下遇铁、铝钝化,在常温下可用铁、铝制容器来盛装浓硫酸或浓硝酸,正确;D、铜的金属活泼性比铁的弱,可在海轮外壳上焊若干铜块,形成原电池,铁作负极,发生氧化反应,加快其腐蚀,错误。
本题难度:一般
2、填空题 由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Cu(OH)2
|
沉淀开始时pH
| 2.7
| 4.1
| 8.3
|
沉淀完全时pH
| 3.7
| 5.4
| 9.8
?
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
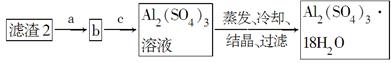
参考答案:(1)烧杯、玻璃棒、漏斗
(2)Al+6H++3NO3
本题解析:(1)进行过滤操作时需要用烧杯盛接滤液,用玻璃棒引流,用漏斗过滤。(2)Cu、Al、Fe、Au、Pt中加入稀硫酸和浓硝酸的混合物并加热时,Cu、Al、Fe都被氧化,硝酸浓度较高时生成NO2,硝酸浓度较低时生成NO,Au、Pt不反应,所以滤渣1为Au、Pt。(3)滤液1中含有Cu2+、Al3+、Fe3+,加入NaOH溶液调溶液pH的目的是实现Cu2+与Al3+、Fe3+的分离,当pH=5.4时,Cu2+没有沉淀,而Al3+、Fe3+沉淀完全,当pH=8.3时,Cu2+开始沉淀,所以调节溶液pH的范围为5.4
本题难度:困难
3、选择题 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是 [???? ]
A.x+2
B.x+4
C.x+8
D.x+18
参考答案:B
本题解析:
本题难度:简单
4、选择题 月球表面土壤里的-种非常有用的资源--可控核聚变的原料,关于的叙述正确的是( ? ) A.3He和4He是同种原子
B.3He和4He互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应
D.在3He中存在:质子数=中子数=核外电子数
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列实验现象描述正确的是
A.HCl与NH3相遇有大量的白烟生成
B.用洁净玻棒蘸取Na2SO4溶液灼烧火焰呈紫色
C.FeCl2溶液与无色的KSCN溶液混合,溶液呈红色
D.SO2通入品红溶液,红色褪去,再加热,红色不再出现
参考答案:A
本题解析:
试题分析:A、HCl与NH3相遇有白烟生成是因为二者结合生成了白色固体氯化铵的缘故,正确;B、钠元素的焰色反应为黄色,错误;C、与无色的KSCN溶液混合,溶液呈红色是铁离子的性质,亚铁离子不具备此性质,错误;D、二氧化硫使品红褪色是因为二氧化硫与品红溶液中的有色物质结合成了不稳定的无色物质,加热又恢复红色,错误,答案选A。
本题难度:一般
|