微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
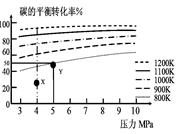
A.上述正反应为吸热反应
B.在4MPa、1200K时,图中X点υ(H2)正 >υ(H2)逆
C.在5MPa、800K时,该反应的平衡常数为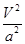 L2·mol-2
L2·mol-2
D.工业上维持6MPa 1000K而不采用10MPa1000K,主要是因
为前者碳的转化率高
2、选择题 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。
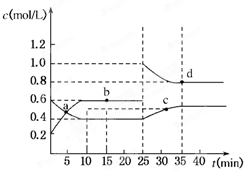
下列推理分析合理的是
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
3、填空题 中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理:
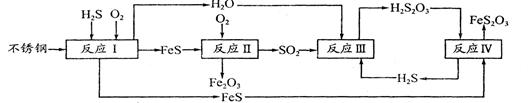
(1)H2S来自合成尿素的天然气。在380 K、体积为2 L的密闭容器中,存在如下反应:H2(g)+S(s) H2S(g)??△H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g)??△H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
(2)在反应I中发生的化学反应为______。
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负
极为______;
已知:Fe(s)+S(s)=FeS(s)?△H1=-2.5akJ·mol-1?
S(s)+O2(g)=SO2(g)??△H2=-5akJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)?△H3=-6akJ·mol-1
则反应II的热化学方程式为_____?????????????????????????????????????????
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2。Na2S2O3水溶液呈______性,该溶液中电荷守恒式为_____???????????????????????????????????????????????????????;反应IY的反应类型为______?????????;该反应______(填“能”或“不能”) 说明FeS溶解性强于FeS2O3
(5)泸天化尿塔的最终腐蚀产物为______;为了有效防腐,北钢建议泸天化在生产中用 CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为
__________________???????????????????????????????????????????????????
4、选择题 有A、B两个起始容积相等的恒温密闭容器,A保持恒压,B保持恒容.起始时向A、B中均通入2molSO2和1molO2后,在一定条件下反应达到平衡.则下列说法中不正确的是
A.达到平衡时,SO2的转化率:A<B
B.起始时的反应速率:A=B,反应完成时的平均速率:A<B
C.达到平衡后再充入等量氦气,A、B中平衡均不发生移动
D.若再向A中充入2molSO3,平衡时SO2的质量分数不变
5、选择题 在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z
初始浓度/mol?L-1
0.1
0.2
0
平衡浓度/mol?L-1
0.05
0.05
0.1
下列说法错误的是( )
A.该反应可表示为X+3Y?2Z
B.反应达到平衡时,X的转化率为50%
C.前5min?以Y表示的平均反应速率为υ(Y)=0.01?mol?L-1?min-1
D.增大压强使平衡向生成Z的方向移动
|