微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 如下图所示是一密闭容器,已知A端盛2.3 g金属钠,B端盛有xg HgO,当同时加热容器的两侧支管时,钠着火燃烧,冷却后测得容器中空气成分并未发生变化,求x的值。(Hg的相对原子质量是200.6)
2、选择题 将含有Mg、Al、Fe的合金15:5g放入足量的NaOH溶液中,在标准状况下收集到3.36L气体;再将等质量的该合金加入到足量的稀H2SO4溶液中,在标准状况下收集到8.96L气体,继续在该溶液中加入足量的NaOH溶液,产生沉淀的质量为[???? ]
A.?35.9g?????
B.?30.8g????
C.?28.1g????
D. 无法计算
3、计算题 某同学取一定量的Al和Fe固体混合物,与2.0?L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4?mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
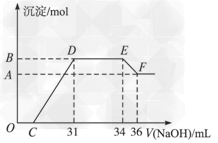
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________。 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________;上述现象说明溶液中______________结合OH-的能力比___________强(填写离子符号)。
(2)B与A的差值为______________mol。
(3)B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
(4)求原硝酸溶液的物质的量浓度??
4、填空题 已知酸性高锰酸钾溶液可以和草酸钠、二氧化硫等物质发生氧化还原反应。
(1)酸性高锰酸钾溶液和草酸钠反应的离子反应式为:MnO4-+C2O42-+H+→CO2↑+Mn2++H2O(未配平) 现称取草酸钠(Na2C2O4)样品,1. 34g溶于稀硫酸中,然后用0.20 mol/L的高锰酸钾溶液滴定(其中的杂质不跟高锰酸钾和稀硫酸反应),达到终点时消耗 了15.00 mL的高锰酸钾溶液。
①判断滴定达到终点时的现象是_________________; ②样品中草酸钠的质量分数为___________。
(2)请写出酸性高锰酸钾和二氧化硫反应的离子反应方程式,并标出电子转移的方向和数目:
_____________________。
5、选择题 将14 g铁粉溶于1 L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加8g,则原溶液中硝酸的浓度为[???? ]
A. 1.0 mol/L
B. 0.8 mol/L
C. 0.6 mol/L
D. 0.4 mol/L